항생제에 의하여 유발되는 발작과 뇌병증
Antibiotics Induced Seizures and Encephalopathy
Article information
Trans Abstract
Drug-induced seizures and delirium are common among patients with critical illnesses, especially those in an intensive care unit. With an increase in the use of potent, broad-spectrum antibiotics, the etiology for encephalopathy remains under-recognized. Antibiotics-induced nonconvulsive seizures should also be considered in patients with unexplained mental status, therefore continuous electroencephalography monitoring is often needed for its detection. Prompt discontinuation, substitution, or dose adjustment of the causative antibiotics might help improve prognosis. Also, antibiotics should be used with caution especially in patients with known epilepsy, central nervous system disorders, critical illnesses, or renal dysfunction.
서 론
의학적 입원 상태에서 섬망 혹은 독성 대사성 뇌병증[1]은 매우 흔하게 접하는 증상으로, 중환자실에서 80% 정도까지 발생한다고 알려져 있다[2]. 대사성 뇌병증이 생기는 환자는 동반 질환을 갖고 있는 경우가 많고 다양한 약을 동시에 투여를 받기 때문에 원인 파악이 어려운 경우가 종종 있으나, 약물에 의한 것으로 여겨지는 경우의 비율은 12-39% 정도가 된다[3]. 또한, 중환자들에게 사용하는 다양한 치료약물들이 뇌전증 발작 발생 위험 역시 증가시키게 된다[4]. 섬망과 발작이 발생하면 환자의 사망률이 높기 때문에, 이를 인지하고 적절히 예방하는 것과 원인을 교정하는 것이 중요하다[5,6]. 점점 다제 내성균의 증가로 인하여 강력하고 광범위한 약효를 지닌 항생제 사용이 늘어나고 있으며[7], 이에 따라 항생제에 유발되는 흔한 신경계 부작용도 주의가 필요하다. 본 종설에서는 중환자들에서 항생제에 의한 발작과 뇌병증의 병태생리, 임상적 특징과 대처 방법에 대하여 기술하려 한다.
본 론
1. 항생제의 뇌혈관장벽 투과기전과 중환자의 취약성
항생제를 포함한 약물이 blood brain barrier (BBB)를 투과하는 기전들에는 항생제의 분자 크기, 지질친화성(lipophilicity), 혈장 단백 결합, 능동 수송이 작용한다. 뇌혈관장벽에 비하여 뇌수막염과 같은 연수막에 염증반응이 있는 상태에서는 소정맥의 세포 간 밀착접합 상태가 느슨해지고, 뇌척수액 흐름의 저항이 늘어나며, 염증매개 사이토카인의 증가로 인하여 P-glycoprotein이 억제된다[8]. 기존에 중추신경계 질환이 있는 환자 혹은 전신 염증반응이 있는 중환자에서는 이러한 기전과 함께, 단백 결합의 저하로 자유 약물이 증가하며, 신기능 저하로 인하여 항생제의 혈액에서의 배출이 감소되어 결과적으로 뇌척수액에서 농도가 증가하여 독성을 일으킬 위험이 높아지게 된다[9]. 대부분의 항생제가 뇌 내의 분포가 높아지는데, 같은 농도라도 항생제의 종류에 따라 발작이나 뇌병증 취약도가 다르게 된다(Table 1).
2. 뇌병증을 일으키는 주요 항생제들
Bhattacharyya 등[10]은 최근 항생제에 의한 뇌병증을 증상과 투여시점-발생 시간적 간격에 따라, 수일 이내 근간대발작이나 뇌전증 발작을 잘 일으키는 약물(type 1), 수일 이내 급성 혼동을 잘 일으키는 약물(type 2) 그리고 수주가 지나 소뇌기능 이상 발생이 특징인 약물(type 3; metronidazole이 해당됨)로 구분하였다. Type 1에 해당하는 항생제는 페니실린(penicillin), 세팔로스포린(cephalosporin), 카바페넴(carbapenem) 등이 해당되며, type 2는 fluoroquinolone, macrolide, sulfonamide, penicillin G procaine 등이다.
1) 페니실린
가장 역사가 오래된 항생제 중에 하나로, 뇌병증의 부작용의 양상과 기전 역시 오래 전부터 알려져 있다. 1947년에 Reuling과 Cramer [11]가 척수강 내로 주입할 경우, 경련을 유발하는 것을 보고하였다. 이후 1960년 대에 정맥이나 근육주사 역시 발작을 유발하는 것이 확인이 되었으며[12,13] 실험적으로 뇌전증 모델(epileptogenic hit)을 만들 때도 사용하게 된다[14].
페니실린의 베타 락탐 구조가 감마아미노부티르산(gamma aminobutyric acid, GABA)의 억제성 신경전달을 억제하고 흥분성 피질 구심성 신경의 강도가 증가되는 것이 뇌전증 발작을 일으키는 주요 원인으로 생각된다[15]. 동물에서 뇌 피질에 페니실린을 적용할 경우 억제성 시냅스 후 전위가 감소하고 흥분성 뉴론의 돌발파 활성이 증가하게 된다[16-18]. 베타 락탐 구조를 갖고 있는 세팔로스포린, 카바페넴, clavulanate 모두가 뇌전증 발작의 위험이 있는데(Fig. 1) 베타 락탐 구조가 penicillase에 의하여 분해되는 정도가 다르며, GABA-a 수용체에 대한 친화도 역시 다른 것으로 알려져 있다[15]. 특히 페니실린은 GABA-a 수용체에 비경쟁적으로 결합한다[19]. Penicillin G 혹은 oxacillin의 경우에는 발작(주로 전신성 근강대발작)이 5% 정도에서 발생하는 것으로 보고되어 있다[20].
2) 카바페넴
β-lactamase 억제 효과가 있는 비교적 최근에 도입된 항생제이다. Imipenem이 카바페넴 항생제 중에 맨 처음 사용되었으며, 미국에서 1985년도에 허가되었다[21]. 페니실린과 비슷하게 베타 락탐 구조가 GABA 수용체에 길항작용을 하여 발작과 뇌병증이 나타나는 것으로 생각되고 있다. 카바페넴 항생제 전체로 보면 발작 위험도는 0.5-0.7%로, 비카바페넴 항생제에 비하여 발작에 대한 odds ratio가 1.87 정도이다[22].
C2 side chain의 GABA 수용체에 대한 친화도의 차이 때문에 카바페넴 종류마다 위험도가 다르다. 특히 imipenem은 이 친화도가 높고, probenecid-like effect가 있는 cilastatin과 함께 합성되기 때문에 더 발생률이 높은 것(5% 정도에서 발작이 발생) [20]으로 알려져 있다[23]. 카바페넴 중 meropenem 역시 다른 계열의 항생제보다 발작 발생률은 낮지 않지만 cilastatin과 독립적으로 생산되므로, 꼭 카바페넴을 사용해야 할 경우에 비교적 안전하게 사용할 수 있다. 최근에 도입된 친수성의 카바페넴인 doripenem은 동물에서 발작 위험이 없었고[24] cilastatin이 포함되어있지 않을 뿐 아니라 GABA 수용체에 친화도가 다른 카바페넴보다 낮기 때문에 발작의 위험도가 비교적 낮은 것으로 생각된다[25].
카바페넴 항생제를 사 용하는 환자에서 항뇌전증 약물치료를 할 경우에는 발프로익산과의 약동학적 상호작용을 고려해야 한다. 직접 발프로익산을 회복시키는 효소인 glucuronidyl-hydrolase을 억제하고, 위장에서 Caco-2 세포에서 흡수를 저해하며, 적혈구에서 xenobiotic exotransporter인 p-glycoprotein을 억제하기 때문에 혈청에서 발프로익산의 농도가 떨어져 항뇌전증 효과를 떨어뜨리기 때문에, 투여 용량의 증량 혹은 다른 항뇌전증 약물 선택을 고려해야 한다[26].
3) 세팔로스포린
세팔로스포린은 신경계 세균성 감염에 자주 사용하는 항생제로, 척수액과 뇌내 농도를 높게 유지할 수 있으나, 동시에 뇌전증 발작을 일으킬 수 있는 위험요소가 된다. 중환자에서 흔한 저알부민 혈증, 신장기능 저하 시에 자유 악물의 농도가 높아져 발작 위험이 더 높아지게 된다[27]. 세팔로스포린은 GABA-a 수용체에 경쟁적으로 결합하며 염증반응 관련 시토카인의 분비를 증가시키는 작용이 있다[28,29]. 다양한 뇌독성 증상을 일으키며 근간대경련, 정위불능증(asterixis) 발작, 비운동성 뇌전증중첩증, 혼수까지 다양한 증상들이 보고되고 있다[30].
1-4세대 세팔로스포린 전부 발작의 위험이 있지만 특히 cefazolin이 신기능 저하 환자에서는 80%까지 발생하는 등 가장 많이 보고되고 있으며 GABA-a 수용체 친화도가 세팔로스포린 중에 가장 높고[31] 축적 효과가 높은 것 때문으로 생각된다[32]. 최근 도입된 약물 중에서는 세페핌의 위험이 높다(약 11%) [20]. 세페핌에 의한 뇌독성을 보고한 연구에서는 특히 만성신기능 저하나 약물 용량을 조절하지 않은 환자에서 뇌병증 발생이 높음을 보여주었다[33]. 이러한 이유로 FDA에서는 2012년에 세페핌의 농도를 조정할 필요가 있음을 권고하였다. 특히, 3세대 혹은 4세대 세팔로스포린은 비운동성 발작, 비경련성 발작중첩증이 경련성 발작보다 많아 유의를 요한다.
4) Fluoroquinolone
DNA gyrase & topoisomerase inhibitor로서 BBB 투과가 다른 항생제에 비하여 떨어지지 않는다. 발작의 위험은 단신 보고들 수준으로 낮으며, 주로 섬망, 환각, 근간대경련, 추체외로 질환의 불수의적 움직임(보행 장애, 구음 장애, 무도증)을 일으킨다[10,34]. 실험적으로는 fluoroquinolone은 GABA를 길항 작용하는 것뿐 아니라, NMDA receptor의 자극을 통하여 집당극파 방전(neuronal population spike)을 증가시키고[35], 도파민 시스템의 과항진을 일으키는 가능성이 제시되고 있다[36].
5) Metronidazole
5-nitroimidazole 유도체인 metronidazole은 과산화 자유 라디칼, 질소 음이온 라디칼, 과산화수소의 신경독성[37] 그리고 티아민 대사 경로에 영향을 끼쳐[38] 소뇌 치아핵, 뇌량, 뇌간에 magnetic resonance imaging 상 변화를 일으킨다[39]. 보통 혈관성, 세포독성 부종으로 나타난다. 증상은 소뇌 실조와 혼동이 나타나고, 항생제를 중단하면 보통 수일에서 수주 내 호전되는 것으로 알려져 있다.
6) 다른 항생제들
병태 생리는 아직 명확히 밝혀져 있지는 않았지만 , macrolide 그리고 trimethoprim/sulfamethaxazole에서 섬망이나 초조, 환각이 발생, clindamycin이 딸꾹질이나 복부의 불수의적 움직임을 일으키는 경우가 있다. Vancomycin을 투여받은 신생아에서 호산구 뇌척수액세포증가증을 동반한 뇌실염이 보고된 경우가 있다[40].
3. 항생제 유발 뇌병증 및 발작에서 지속적 뇌파 감시의 유용성
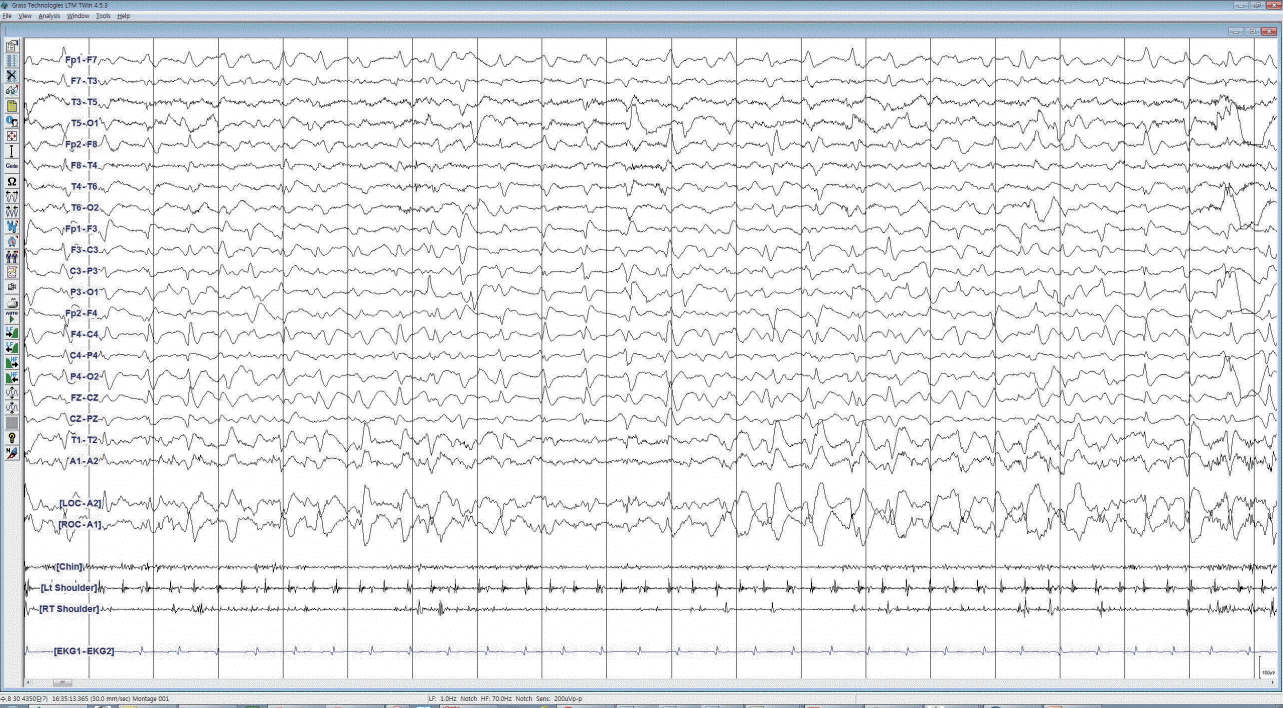
노인이나 진정제 투여를 받고 있는 중환자들에서는 뇌전증 발작 증상 자체가 미약하거나 모호하게 나타나고, 다른 원인의 섬망과 구분하기 어려운 경우가 많다[41]. 원인이 불명확한 의식수준이나 인지 증상의 변동이 있는 환자에서는 비경련 뇌전증 발작 감별을 위하여 지속적 뇌파 감시가 도움이 될 수 있다[42]. 항생제 유발 뇌병증 중에서 세팔로스포린이 특히 비경련뇌전증지속상태를 일으키는 경우가 많아(Fig. 2) [43,44], 유의를 요한다.
4. 항생제에 유발된 뇌병증과 발작의 대처 방법
신기능 저하, 대사기능 저하가 있는 소아나 노인 환자, 기존에 중추신경계 질환이 있는 환자에서는 항생제를 선택할 때 중추신경계 감염을 꼭 치료할 필요가 없는 경우는 뇌혈관장벽의 투과가 적은 약물을 선택하는 것이 원칙이며, 사용하더라도 적절한 효과적인 용량으로 사용하여야 한다. 발작이나, 뇌병증, 신경병증이 나타났을 경우에는 원인이 되는 약물을 중단하고 신경계 독성이 적은 약물로 대체를 해야 하지만, 약물을 중단한 후에도 지속이 되는 경우에는 적극적으로 뇌파 감시를 하여 발작이나 비경련뇌전증지속상태 유무를 확인하여 항뇌전증 약물 투여를 고려한다. 세팔로스포린, fluoroquinolone이나 polymyxin의 경우에는 투석이나 지속적 신대체 요법(continuous veno-venous haemofiltration)으로 약물의 혈장 제거를 시도해 볼 수 있다[45]. 발작을 제외한 혼동과 초조, 공격성을 보이는 뇌병증 역시 원인이 되는 약물을 중단하는 것이 첫 번째로 고려되어야 하며, 섬망에 사용하는 치료 원칙과 벤조디아제핀이나 항정신병 약물 투여를 고려해 볼 수 있다[3].
결 론
중환자들에게서 강력한 항생제의 종류와 사용이 늘면서 뇌병증과 발작의 위험도 흔하게 발생한다. 신경학적 증상이 발생한 중환자에게서 약물의 투여 시점과 임상양상, 다른 동반요인을 고려하여, 항생제에 의한 것으로 판단된다면 원인 약물의 중단, 용량 조절 혹은 대체를 고려하여야 한다. 의식변화를 보이는 환자에게서 적극적인 뇌파 감시가 발작이 동반되는지 감별에 도움이 될 수 있으며, 발작이 동반된 경우에 적극적인 항뇌전증 약물 투여가 도움이 되는지에 대해서는 앞으로 더 연구가 필요하다.