자가면역 뇌염에서 코르티코스테로이드 치료
Corticosteroid Treatment in Autoimmune Encephalitis
Article information
Trans Abstract
An increasing number of neuronal autoantibodies which target cell surface or synaptic proteins have been discovered over the last decade. Autoimmune encephalitis refers to this new category of autoimmune-mediated neurological disorders, which involve the central nervous system. Recent studies have established that autoimmune encephalitis is now the major cause of encephalitis, which was previously considered to be encephalitis of an unknown etiology. Moreover, the fact that autoimmune encephalitis is potentially treatable with immunomodulating therapy has changed the paradigm for the diagnosis and treatment of acute encephalitis syndrome. We herein review the pathophysiology, clinical manifestations, diagnosis, and treatment of autoimmune encephalitis with a focus on corticosteroid therapy as the first-line immunotherapy. In addition, regarding the diagnostic approach, we emphasize the differentiation between autoimmune and infectious encephalitis, because this distinction is not necessarily clear-cut in real clinical practice and should be considered when determining the initiation and type of immunotherapy.
서 론
뇌염(Encephalitis)은 뇌실질을 침범하는 염증성 질환으로 환자가 사망에 이를 수 있는 중증 신경학적 질환이다[1]. 고소득 국가에서 뇌염의 발생률은 한해 10만 명당 5-10명으로 추정되며, 모든 연령에서 발생 가능하고 환자에게 영구적인 신경학적 결손을 유발하여 아니라 사회경제적 부담을 유발한다[2]. 과거부터 뇌염의 원인을 찾기 위해서 감염성 질환을 중심으로 매우 다양한 검사를 시행하여 왔으나, 약 60%에서 뇌염의 원인은 끝까지 밝혀지지 않았다[3]. 하지만, 최근 십 수년에 걸쳐 뇌염의 새로운 원인으로 신경세포 표면 또는 시냅스 단백질에 대한 자가항체가 밝혀지면서 뇌염의 진단적 접근 방식이 바뀌고 있다[4]. 최근 인구기반 전향적 연구 결과에 따르면 203명의 뇌염 환자의 원인질환으로 자가면역(autoimmune) 뇌염이 21%를 차지하였다[5]. 게다가 30세 이전의 젊은 뇌염 환자의 원인을 분석한 결과 항 N-methyl-d-aspartate receptor (NMDAR) 뇌염이 차지하는 비율이 41%에 달하였는데, 이는 그 어떤 바이러스 뇌염보다도 높은 비율이었다[6]. 참고로, 단순 헤르페스바이러스(herpes simplex virus) 뇌염이 차지하는 비율은 9%밖에 되지 않았다. 이제 자가면역 뇌염은 가장 중요한 뇌염의 원인질환으로 간주되고 있을 뿐 아니라, 새로운 자가항체(autoantibody)가 발견됨에 따라서 자가면역 뇌염이 차지하는 임상적 영역은 점차 증가하고 있다. 본 종설에서는 자가면역 뇌염의 임상 양상, 진단 및 치료에 대해서 개괄적으로 살펴보고, 면역치료(immunotherapy)에 대한 내용은 코르티코스테로이드(corticosteroid)를 중점적으로 다루고자 한다.
본 론
1. 자가면역 뇌염의 병태 생리
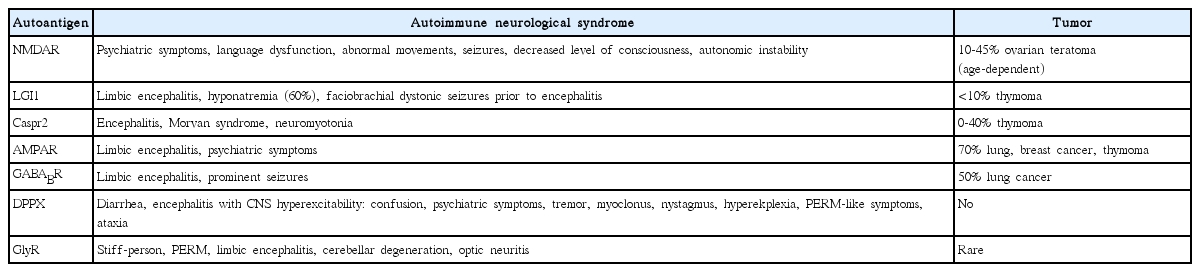
자가면역 뇌염은 자가항체가 결합하는 항원의 위치에 따라 크게 두 가지로 구분할 수 있으며, 이에 따라 서로 다른 병태 생리 및 임상적 특징을 갖는다(Table 1). 첫 번째는 세포내(intracellular) 항원에 반응하는 자가항체로 anti-Hu 항체가 대표적이며, 종양과의 높은 연관성으로 부종양성 (paraneoplastic) 혹은 종양신경성(onconeuronal) 항체로 불린다. 부종양성 자가항체는 뇌염 환자의 중추신경계에 존재하지만, 자가항체가 직접적으로 체액성(humoral) 면역반응을 통해서 직접적으로 질병 발생에 관여하지는 않으며[7], 대신 T세포 매개 기전을 통해서 핵 또는 세포질내 위치한 항원을 목표로 하는 부종양성 뇌염을 유발하는 것으로 간주된다[8]. 예를 들어 소세포폐암(small cell lung cancer)에서 발현되는 Hu 단백은 자가면역반응으로 Hu 단백에 반응하는 세포독성 T세포가 생성되고, T세포 매개 면역반응으로 인한 신경학적 손상이 부종양성 뇌염과 관련된 신경학적 증상을 유발한다[9]. 상기 기전으로 부종양성 자가면역 뇌염은 신경세포의 비가역적인 손상을 유발하기 때문에 예후가 상대적으로 불량하다. 비록 부종양성 자가항체가 직접적으로 신경세포 기능 이상을 유발하지는 않지만, 자가면역 뇌염 환자에서 종양 표지자(tumor marker)로써 가치가 있으며, 또한 부종양성 신경학적 증후군의 중증도 모니터링에도 유용하게 사용된다[10]. 두번째 그룹은 신경세포 표면(neuronal cell surface) 항원에 결합하는 자가항체 매개 뇌염이다. 자가면역반응을 유발하는 세포 표면 항원으로 NMDAR가 가장 대표적이며, 이외에도 γ-aminobutyric acid receptor-B (GABABR), leucine-rich gliomainactivated protein 1 (LGI1), contactin-associated protein-like 2 (Caspr2), glycine receptor (GlyR) 등이 있다[11,12]. 상기 세포 표면 항원과 관련된 자가면역 뇌염은 자가항체에 의한 체액성 면역 반응이 해당 항원의 기능과 시냅스 전달을 방해하여 자가면역 뇌염의 병태 생리에 직접적으로 관여한다. 항 NMDAR 항체의 경우 시냅스에 위치하는 NMDAR를 내재화(internalization) 시킴으로써 수용체의 발현 레벨을 감소시키고, 결과적으로 NMDAR 의존성 시냅스 전류를 억제하여 신경학적 증상을 유발한다[13,14]. 이런 자가항체 매개 자가면역 뇌염은 상대적으로 신경세포 사멸이 적기 때문에 면역치료를 통해 자가항체를 제거하고 시냅스 전달을 회복시키면 신경학적 증상이 회복될 수 있다. 또한 세포내 항원과 관련된 부종양성 뇌염과 비교하여 종양과의 관련성이 낮기 때문에, 전체적인 예후가 상대적으로 양호하다. 이후 본 종설은 신경세포 표면 항원과 관련된 자가면역 뇌염에 초점을 두고 진행한다.
2. 자가면역 뇌염의 임상 양상
1) 전반적인 임상 양상
자가면역 뇌염의 임상증상은 원인 자가항체에 따라서 다양하게 나타날 수 있지만, 질병 초기 단계에는 상당 부분 공통된 임상 양상을 보인다. 초기 증상은 수일에서 수주 사이에 빠르게 진행하는 양상으로 전개되는데, 두통이나 미열 등의 비특이적 증상이 초기에 나타날 수 있다. 기분의 변화, 행동 이상, 기억력 장애, 의식 저하, 경련이 가장 흔하고 일반적인 발현 증상이지만, 대부분의 자가면역 뇌염에서 공통적으로 나타나기 때문에 상기 증상만으로 원인 자가항체를 결정하기는 어렵다. 하지만, 자가항체에 따라서 발생 가능한 신경학적 증후군이 다르고, 자가항체별로 특징적인 증상 및 징후가 존재하기 때문에, 동반된 종양의 유무 및 뇌 자기공명영상 소견 등의 정보를 종합하면 원인 자가항체에 대한 임상적 추정이 가능하다. 뇌척수액검사 결과 자가면역 뇌염의 80% 이상에서 경도-중등도의 뇌척수액 백혈구증가증(pleocytosis)이 관찰되며, 단백질 수치의 증가는 약 30%에서 나타나고 뇌척수액 올리고클론띠(oligoclonal band)는 50-60%에서 확인된다[11]. 자가면역 뇌염에서 뇌 자기공명영상 결과는 주로 내측 측두엽을 침범하는 T2 고신호강도 병변이 대표적이지만, 정상인 경우도 흔하다[15,16]. 또한, 내측 측두엽 병변의 경우 단순헤르페스뇌염이나 다른 바이러스성 뇌염에서도 비슷하게 나타날 수 있고[17], 부종양성 변연계(limbic) 뇌염이나 신경계 매독에서도 나타날 수 있다는 점을 염두에 두어야 한다[18].
2) 항 NMDAR 뇌염의 임상 양상
항 NMDAR 뇌염은 가장 흔한 신경세포 표면 항원에 대한 자가면역 뇌염이다. 2012년부터 2015년까지 발생한 국내 자가면역 뇌염에 대한 조사 결과, 신경세포 표면 항원에 대한 자가면역 뇌염 중 항 NMDAR 뇌염이 68%로 가장 많았고, 그 다음으로 항 LGI1 뇌염이 22%로 많았다[19]. 항 NMDAR 뇌염의 전형적인 임상 양상을 살펴보면 다음과 같다. 주로 젊은 여성에서 호발하고 초기에 이상행동 및 불안, 환각, 불면, 조증, 긴장증(catatonia) 등 정신과적 증상이 두드러지게 나타난다[13,20,21]. 이후에 다양한 형태의 불수의적 운동이 나타나는데 입 주변의 이상운동증(orofacial dyskinesia)은 비교적 항 NMDAR 뇌염에 특징적인 소견이다. 질병이 진행하면 혼미(stupor) 혹은 혼수(coma)까지 의식 수준이 저하되며 심한 자율신경 조절 장애가 흔히 동반되어 심한 혈압 변동, 고체온증, 타액과다분비 (sialorrhea), 심방빈맥, 호흡 저하 등이 발생한다[22,23]. 경련 혹은 뇌전증지속상태(status epilepticus)는 항 NMDAR 뇌염의 모든 단계에서 발생이 가능하다. 뇌파에서 국소적 혹은 전반적인 서파(slow activity)는 모든 종류의 자가면역 뇌염에서 비특이적으로 관찰되지만, 예외적으로 1-2 Hz 주파수의 율동성 델타 리듬(rhythmic delta activity)과 그 위에 베타 주파수의 빠른 돌발파(superimposed bursts of beta activity)가 중첩되어 나타나는 소견, 이른바 extreme delta brush 패턴은 항 NMDAR 뇌염에 특이적인 뇌파 소견으로 간주된다[24]. 항 NMDAR 뇌염 환자 중 전체적으로 약 40%에서 종양이 발견되는데, 그중 난소의 기형종이 94%로 대부분을 차지한다[20]. 종합하면, 난소 기형종을 동반한 젊은 여성, 뚜렷한 정신과적 증상으로 발현, 이상운동증, 심한 자율신경 조절 장애, 특징적인 뇌파 결과 등은 자가면역 뇌염의 원인이 항 NMDAR 항체일 가능성을 시사하는 중요한 단서가 된다. 자가면역 항체별 대표적인 신경학적 증후군과 종양 연관성을 Table 2에 정리하였다. 항 NMDAR 항체 외 다른 자가면역 항체의 임상적 특징은 기존에 출판된 종설에 잘 정리되어 있으므로 이들을 참고할 것을 추천한다[25,26].
3. 자가면역 뇌염의 진단 및 감염성 뇌염의 감별
자가면역 뇌염 진단의 핵심은 실험실 검사를 통해서 혈액 혹은 뇌척수액 샘플에서 뇌염의 원인이 되는 자가면역 항체를 검출하는 것이다. 특히 뇌척수액 샘플에서 항체검사를 시행하는 것이 중요한데, 항 NMDAR 뇌염의 경우 혈액 샘플만 검사할 경우 14%는 위음성으로 나타나기 때문이다[27]. 자가면역 항체의 검출방법은 크게 세 가지가 사용되는데 조직 기반 분석(tissue-based assay), 세포 기반 분석(cell-based assay) 그리고 면역침윤법(immunoprecipitation)이다. 쥐의 뇌조직에 환자 샘플을 반응시키는 조직 기반 분석은 자가항체 유무에 대한 선별검사로 활용되며, 이후 특정 자가항체에 대한 규명은 세포 기반 분석 또는 면역침윤법을 통해 확인한다. 자가항체의 실험실적 진단 방법에 대한 자세한 내용은 다른 종설을 참고할 것을 추천한다[28]. 자가항체검사를 해석할 때 자가면역 뇌염 환자에서 항체 결과가 위음성으로 나타날 수 있다는 점을 명심해야 한다. 이는 항체의 양이 적거나, 타겟 항원에서 사람과 쥐 사이에 구조적 차이가 있는 경우 그리고 체액성 면역 보다 T세포 매개 세포성 면역과정이 우세한 자가면역 뇌염의 경우 등으로 위음성 결과가 나타날 수 있다. 게다가, 항체 검사 결과가 음성인 자가면역 뇌염 의심 환자에서 약 44%에 달하는 환자들이 rituximab 치료 후 호전된 결과 역시 항체 음성 자가면역 뇌염이 드물지 않다는 사실을 뒷받침한다[29]. 반대로, 자가항체가 검출되었다고 반드시 자가면역 뇌염이 진단되는 것은 아니며, 검출된 자가항체가 꼭 뇌염의 원인 항체를 의미하는 것도 아니다. 예를 들어 소세포폐암 환자 중 일부는 뇌염의 증상이 없는 상태에서 항 Hu 항체가 검출될 수 있다[30].
자가면역 항체를 검출하면서 동시에 감염성 원인을 배제하는 것은 자가면역 뇌염의 진단에 있어서 필수적인 과정이다. 뇌염의 진단뿐 아니라 치료적 접근에 있어서도 면역치료, 특히 스테로이드 치료 여부를 결정하기 위해서 감염성 뇌염을 배제하는 것은 중요하다. 하지만, 실제 임상에서 감염성과 자가면역성 뇌염 간의 명확한 구별이 어려운 경우가 드물지 않게 발생한다. 뇌염의 원인을 찾기 위해서 바이러스를 포함한 감염성 원인에 대한 검사는 동시에 진행되어야 하며, 감염성 질환의 가능성이 배제되기 전까지 경험적인 항바이러스제 또는 항생제 치료를 하는 경우가 흔하다[10]. 감염성 뇌염을 감별하기 위해서 여행력이나 기타 원인균에 노출될 만한 병력이 있는지 조사하는 것이 중요하다. 또한 환자의 면역 상태에 따라서 감염성 질환의 위험도가 다르기 때문에 사람면역결핍 바이러스(human immunodeficiency virus) 감염 여부, 장기이식 또는 항암치료 병력 등을 확인해야 한다. 면역이 약화된 환자에서 발생하는 뇌염의 가장 흔한 감염성 원인은 단순헤르 페스바이러스와 수두대상포진바이러스(varicella zoster virus)이다[31]. 장기이식 후 면역억제치료를 받는 환자의 경우 장기 제공자로부터 전파되는 감염성 질환을 고려해야 하는데, 가능한 병원체로 rabies virus, lymphocytic choriomeningitis virus, West Nile virus, cytomegalovirus, Epstein-Barr virus 등이 있다[32]. 이식 후 면역억제제 치료 중인 환자에서 발생한 뇌염의 감별진단으로 human herpes virus-6 (HHV6)와 BK virus를 고려해야 한다. 초기 임상증상으로 감염성 뇌염은 대부분 발열이 있지만, 자가면역 뇌염에서 발열은 상대적으로 드물며 절반 정도 환자에서만 나타난다[5,6]. 뇌척수액검사에서 자가면역뇌염에서 관찰되는 백혈구증가증은 바이러스성 뇌염에 비해서 정도가 경미한 편이다[33]. 또한, 자가면역 뇌염에서 뇌척수액 포도당 수치는 보통 정상이고 단백질 수치는 정상이거나 약간 증가하는 반면, 결핵을 포함한 세균성 감염에서는 뇌척수액 포도당 수치가 감소하는 차이가 있다[5]. 뇌 자기공명영상은 자가면역 뇌염, 특히 변연계 뇌염의 진단에 유용한데, 전형적인 소견은 편측 혹은 양측 내측 측두엽을 침범하는 T2 고신 호강도 병변이다. 이런 양상의 자기공명영상을 보일 수 있는 감염성 뇌염의 원인 병원체로 단순헤르페스바이러스, HHV6, 매독 등이 있다[34]. 하지만, 단순헤르페스바이러스 뇌염은 내측 측두엽에만 병변이 국한되지 않고 대상피질과 섬이랑 영역까지 광범위하게 침범하는 경우가 흔하다는 것이 감별점이다. 단순헤르페스바이러스 뇌염 진단에서 초기 48시간 동안에는 뇌척수액 중합효소연쇄반응 검사에서 위음성 결과가 나타날 수 있음을 염두에 두어야 한다[35]. 내측 측두엽 병변이 해마 꼬리(hippocampal tail) 영역을 주로 침범하고 특히 시상(thalamus)의 병변이 동반된 경우는 일본 뇌염(Japanese encephalitis)을 반드시 감별해야 한다[36].
4. 자가면역 뇌염의 치료 개괄
자가면역 뇌염에서 면역치료의 효과는 말초신경계 자가면역질환인 중증근무력증(myasthenia gravis)이나 Lambert-Eaton 증후군과 비교하면 상대적으로 덜한 편이다. 이는 대부분의 자가면역 뇌염에서 수막공간내(intrathecal) 항체 생성이 일어나고 형질세포(plasma cell)를 포함한 병원성 면역 세포들이 이미 중추신경계에 침윤되어 있기 때문이다[37,38], 즉, 말초경로를 통해 주입되는 면역치료제가 중추신경계 내부에서 일어나는 면역반응 및 항체생성 과정까지는 효과적으로 억제하지 못하는 것으로 해석 가능하다[39]. 수막공간내 항체 생성이 잘 나타나지 않는 항 LGI1 뇌염이 코르티코스테로이드 또는 정맥내 면역글로불린(intravenous immunoglobulin) 등의 면역치료에 상대적으로 우수한 치료 효과를 보이는 결과도 같은 맥락이다.
아직까지 자가면역 뇌염에 대한 표준화된 면역치료 프로토콜은 없는 실정이다. 하지만 다른 염증성 질환과 마찬가지로 염증반응 전반에 작용하는 코르티코스테로이드는 자가면역뇌염에서도 일차 면역치료제로 가장 흔히 사용된다. 일차적으로 사용 가능한 다른 면역치료제로 자가항체와 면역 매개물질에 작용하는 정맥내 면역글로불린과 혈장교환술(plasma exchange)이 있다. 정맥내 면역글로불린은 특히 감염성 질환을 악화시키지 않기 때문에, 감염성 뇌염과의 감별이 불분명하거나 자가면역 뇌염 환자에서 전신 감염증이 동반된 경우에도 사용할 수 있는 장점이 있다. 코르티코스테로이드 관련 부작용이 있거나 glutamic acid decarboxylase 65 (GAD65) 항체 양성 환자와 같이 당뇨병의 위험이 있는 경우에도 코르티코스테로이드 대신에 정맥내 면역글로불린이 대안으로 사용된다[40]. 일차 면역치료 이후에 신경학적 회복이 뚜렷하지 않거나 불충분한 경우 이차(second-line) 면역치료를 하게 되는데, 그 시작 시점에 대한 지침은 아직까지 없다. 일부 그룹은 일차 치료제가 효과를 나타낼 수 있도록 투약 이후 2주 이상 관찰하기도 하지만, 다른 그룹은 일차치료의 효과가 불분명한 경우 혹은 혼수상태가 지속되는 중증 뇌염의 경우 일차 면역치료에 잇따라 바로 이차치료를 시작하기도 한다.
사용 가능한 이차치료 옵션으로 B세포 및 수명이 짧은 (short-lived) 형질세포에 작용하는 rituximab, 시토카인 (cytokine) 매개 면역반응을 조절하는 tocilizumab과 저용량 interleukin-2 등이 있다[41,42]. Rituximab은 CD20을 목표로 하는 단클론항체로써 CD19와 CD20을 발현하는 B세포를 고갈시킨다[43]. 일차치료에 반응하지 않는 자가면역 뇌염에서 rituximab의 효과는 여러 연구에서 보고되었으며, 안정성 측면에서 비교적 양호한 결과를 보여 점차 자가면역 뇌염의 치료제로써의 입지가 늘어나고 있다[29]. 뿐만 아니라, 세포증식 억제제에 해당하는 cyclophosphamide, azathioprine, mycophenolate mofetil 등도 난치성 자가면역 뇌염의 치료나 관해 후 유지치료에 사용된다. 하지만 cyclophosphamide는 불임의 위험이 있기 때문에 특히 젊은 여성에서 사용은 주의가 필요하다. 여성환자에서 cyclophosphamide 관련 불임 위험은 gonadotropinreleasing hormone agonist 사용으로 줄일 수 있으며, 또한 사전 난세포 수집을 통해 해결할 수도 있다[44].
5. 코르티코스테로이드 치료
코르티코스테로이드는 다양한 염증성 질환 및 자가면역질환에서 가장 효과적이고 널리 쓰이는 약물이다. 자가면역 뇌염의 일차 면역치료에도 코르티코스테로이드가 가장 많이 사용된다. 항 NMDAR 뇌염에서 면역치료 효과에 대한 메타분석에서 761명의 환자에서 사용된 일차 면역치료제로 코르티코스테로이드 83.3%, 정맥내 면역글로불린 66%, 혈장교환술이 31.1% 비율로 보고되었다[45]. 코르티코스테로이드의 주된 작용기전은 염증 과정에서 발현이 증가되는 시토카인, 케모카인(chemokine), 염증성 효소 및 수용체, 세포 부착 관련 물질 등의 전염증성(pro-inflammatory) 유전자의 발현을 억제하는 것이다[46]. 시토카인을 포함한 전염증성 신호의 감소는 T세포의 고갈, 대식세포의 기능 저하, 호산구의 사멸을 유발한다. 고농도에서는 추가적으로 후생적 조절을 통해서 항염증성 (anti-inflammatory) 단백의 합성을 증진시키는 효과도 있다. 추가적으로, 코르티코스테로이드는 중추신경계 염증으로 손상된 혈관-뇌 장벽을 복원하고 뇌 부종을 감소시키는 효과도 있다[47].
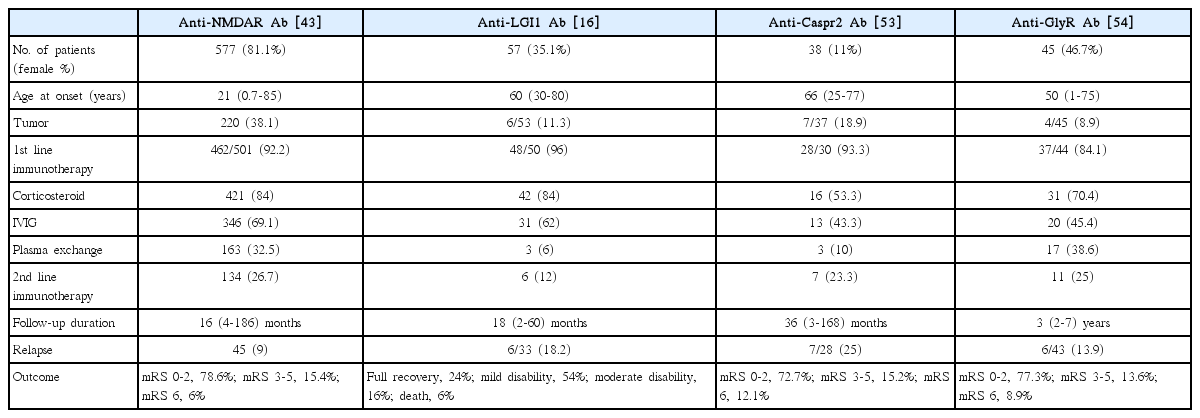
자가면역 뇌염에서 일차 면역치료로 사용되는 코르티코 스테로이드 치료 요법은 정맥내 메틸프레드니솔론 (methylprednisolone) 1,000 mg을 3일에서 5일간 사용하는 것이다[45]. 이후에 경구 스테로이드 제제로 변환하여 수주에 걸쳐 서서히 감량하는 경우도 있고, 일부 연구자들은 이런 tapering-off 과정 없이 스테로이드 치료를 바로 종료하기도 한다. 코르티코스테로이드와 정맥내 면역글로불린을 함께 사용하는 경우도 비교적 흔한데, Titulaer 등[43]이 보고한 577명 항 NMDAR 뇌염 환자 분석에 따르면 44%의 환자에서 코르티코스테로이드와 정맥내 면역글로불린이 함께 사용되었다. 정맥내 면역글로불린을 동시에 투약할 경우 코르티코스테로이드 제제를 정맥내 메틸프레드니솔론 대신 경구 프레드니솔론 (prednisolone)을 하루 60 mg 용량으로 사용하기도 한다[40].
자가면역 뇌염에서 코르티코스테로이드의 효과는 여러 연구를 통해서 확인되었고, 접근성 및 비용 효율성 측면에서도 우수한 면역치료제이다[45]. 하지만 코르티코스테로이드 사용에 있어서 몇 가지 주의해야 할 사항이 있는데, 첫 번째로 자가면역 뇌염의 급성기에 감염성 뇌염과의 감별이 어려운 상황에서 코르티코스테로이드를 바로 사용하기 어렵다는 점이다. 뿐만 아니라 폐렴 등 전신적인 감염이 동반된 경우 역시 코르티코스테로이드 치료는 지연된다. 두 번째 이슈는 코르티코스테로이드가 항체를 생성하는 B세포에 미치는 영향은 T세포를 억제하는 영향에 비해서 훨씬 적다는 점이다[48]. 따라서 코르티코스테로이드가 혈중 항체 농도를 감소시키는 효과는 상대적으로 제한적이며[49], 자가면역 항체가 직접적으로 질병 발생에 관여하는 자가면역 뇌염(항 NMDAR 뇌염 등)에서 코르티코스테로이드 치료의 효과는 T세포 매개 자가면역 뇌염(부종양성 자가면역 뇌염)에 대한 효과에 비해서 상대적으로 낮다. 즉, 자가면역 항체의 역가를 효과적으로 낮추기 위해서는 코르티코스테로이드 치료만으로 부족할 수 있기 때문에 B세포를 억제하는 면역치료를 병행하는 것을 고려해야 한다. 세번째로, 코르티코스테로이드 치료가 자가면역 뇌염에서 발생하는 정신과적 증상, 예를 들어 우울, 불안, 초조, 불면, 망상, 정신병증 등을 악화시킬 수 있다는 점이다[50]. 따라서 정신과적 증상이 심하고 정서가 불안정한 상태에서는 코르티코스테로이드가 아닌 다른 일차 면역치료제를 대안으로 선택할 수 있다.
6. 자가면역 뇌염에서 일차 면역치료 효과(코르티코스테로이드 포함)
항 NMDAR 뇌염 환자 577명을 분석한 연구 결과에 따르면, 일차 면역치료제로 84%에서 코르티코스테로이드, 69%에서 정맥내 면역글로불린, 33%에서 혈장교환술이 사용되었다[43]. 증상 발생부터 일차 면역치료 시작까지 소요된 시간은 약 21일로 보고되었다. 스테로이드와 정맥내 면역글로불린은 종양이 동반되지 않은 뇌염에서 더 빈번하게 사용된 반면, 혈장교환술은 종양이 동반된 뇌염 환자에서 더 많이 사용되었다. 대부분 코르티코스테로이드와 함께 다른 일차, 이차 면역치료제가 사용되기 때문에 코르티코스테로이드 단독치료에 대한 효과는 파악하기 어렵다. 전체 항 NMDAR 뇌염 환자 중 24개월째 modified Rankin scale (mRS) 점수 0-2점으로 회복한 경우는 총 81%였는데, 일차 면역치료를 받은 환자를 대상으로 하면 회복군의 비율이 91%까지 증가한다. 특히, 면역치료를 조기에 시작할수록 좋은 예후를 보일 가능성이 유의하게 증가하는 결과를 보였다.
두 번째로 흔한 자가면역 뇌염인 항 LGI 뇌염의 면역치료 연구 결과를 종합하면, 전체 105명의 환자 중 약 89.5%에서 코르티코스테로이드, 50%에서 정맥내 면역글로불린, 14.1%에서 혈장교환술이 일차 면역치료제로 사용되었다[45]. 이는 항 NMDAR 뇌염의 면역치료 패턴과 유사하게, 코르티코스테로이드가 항 LGI 뇌염의 일차 면역치료제로 가장 흔하게 사용된다는 사실을 보여준다. 일차 면역치료의 효과 역시 비슷한 결과를 보이는데, 92%의 환자에서 mRS 2점 이하의 신경학적 회복을 보였고, 86.4%에서 경련 관해에 성공하였다[16]. 한 연구에서 면역치료 종류에 따른 효과를 비교하였는데, 코르티코스테로이드 단독치료에 비해서 정맥내 면역글로불린을 함께 사용하는 복합 면역치료가 유의하게 신경학적 회복을 증가시키는 결과를 보였다[51]. 면역치료의 시점과 관련해서 항 NMDAR 뇌염과 마찬가지로 조기에 치료가 시작될수록 인지 기능 저하가 발생하는 비율이 감소하고 신경학적으로 좋은 예후가 더 많이 관찰되었다[52]. 자가면역 뇌염의 대표적인 원인 항체별로 코르티코스테로이드를 포함한 면역치료 효과에 대한 결과를 Table 3에 정리하였다.
결 론
종합하면, 자가면역 뇌염, 특히 세포 표면 항원에 대한 자가항체 매개 뇌염의 일차 면역치료로 코르티코스테로이드는 가장 흔하게 사용된다. 코르티코스테로이드를 포함한 일차 면역치료의 효과는 비록 무작위 대조 연구를 통해 입증되지는 않았지만, 다수의 관찰 연구 결과 자가항체 매개 뇌염에서 치료 효과는 충분히 확인되었다. 특히 면역치료를 조기에 시작할수록 좋은 예후를 기대할 수 있기 때문에, 자가면역 뇌염이 의심되는 환자의 치료에서 코르티코스테로이드 치료를 조기에 시작할 필요가 있다. 우수한 비용 효율성 및 접근성을 고려하면 자가면역 뇌염의 치료제로 코르티코스테로이드를 일차적으로 선택하는 것은 합리적이다. 하지만, 감염성 뇌염의 감별이 불분명하거나 다른 동반 질환으로 인해 코르티코스테로이드를 즉각적으로 투여하기 어려운 경우에는 정맥내 면역글로불린이나 혈장교환술 등의 다른 일차 면역치료를 대안으로 선택해야 한다. 질병의 중증도가 심한 경우 더 효과적으로 면역반응을 조절하기 위해서 초기부터 정맥내 면역글로불린과 코르티코스테로이드를 동시에 사용하는 방법도 고려할 수 있으며, 이에 대한 임상적 효용성을 입증하기 위해서는 추가적인 연구가 필요하다.