정맥내 스테로이드 투여 후 빠른 회복을 보인 Marchiafava-Bignami disease
Rapid Recovery from Marchiafava-Bignami Disease after Intravenous Corticosteroid Administration
Article information
Trans Abstract
Background:
Marchiafava-Bignami disease (MBD) is a rare disorder characterized by acute demyelination of the corpus callosum in people with chronic alcoholism. Early thiamine treatment can reduce neurological complications of MBD. However, the outcome of MBD is usually unfavorable. Here we report a case of MBD responded to intravenous corticosteroid administration.
Case Report:
46-year-old woman with chronic alcoholism presented to our emergency department with two days of dysarthria, dysphagia, extremity weakness, and decreased consciousness. Diffusion-weighted image and fluid attenuated inversion recovery revealed high signal intensities of the left frontal cortex and the entire corpus callosum. After receiving high dose intravenous thiamine and multivitamin, she did not improve. At the third day of admission, intravenous steroid was started. Her mental status and weakness were rapidly improved. At 2 weeks later, she could walk independently. Follow-up MRI revealed only a small lesion in the splenium of corpus callosum.
Conclusion:
The MBD in our case is associated with thiamine deficiency with main pathology of edema and demyelination of corpus callosum. Corticosteroid stabilized blood brain barrier and reduced inflammation and edema. Therefore, corticosteroid therapy might have beneficial effects as an alternative therapy for MBD.
서 론
Marchiafava-bignami disease (MBD)는 만성 알코올 중독이나 영양실조와 관련되어 발생하는 드물고 치명적인 질환으로, 병리학적으로 뇌량(corpus callosum)의 괴사(necrosis) 및 탈수초(demyelination)가 특징이다[1]. 임상적으로는 경련, 구음장애, 사지마비, 보행장애 등의 신체증상 및 의식저하, 환각, 망상, 반구간 해리증상(interhemispheric disconnection symptoms) 등의 정신증상을 보인다[1,2]. 확진은 사망 후 병리학적인 소견을 통해 가능하지만, 흔히 뇌 자기공명영상(magnetic resonance imaging, MRI)의 특징적인 소견을 통해 진단된다.
보존적 치료 외에 MBD의 정립된 치료는 없으나 일반적으로 티아민 투여가 좋은 예후와 관련이 있으며[3] 스테로이드에 반응을 보인 증례 보고들도 있다[3-8]. 국내에서도 티아민 투여에 반응을 보인 여러 보고들이 있으며[9-11] 스테로이드 치료를 시도한 증례도 있으나 임상 호전을 보이지는 못했다[12]. 저자들은 MBD 환자에서 정맥내 스테로이드 투여를 통해 좋은 경과를 보였던 예를 경험하여 문헌고찰과 함께 보고한다.
증 례
46세 여자가 내원 2-3일 전부터 아급성으로 발생하여 진행하는 혼동(confusion), 구음장애, 사지 위약을 주소로 응급실에 내원하였다. 환자는 약 6년 전부터 하루에 소주 2-3병 정도를 매일 마시는 만성 알코올중독자(alcoholic)였으며, 평소 식사를 제대로 하지 않았다. 수 차례 알코올 전문병원에서 입원 치료를 받았으며 다른 특이 병력은 없었다.
내원 당시 혈압은 155/90 mmHg, 맥박수는 103회/분, 호흡수 18회/분, 체온은 36.6℃였다. 매우 마른 체형이었으며 신경학적 진찰에서 의식은 명료하였으나 스스로 말하기(spontaneous speech)가 매우 감소하였고 1단계 명령(one stage command)에도 따르지 못했다. 외안근(extraocular muscle) 운동의 제한이나 안진은 관찰되지 않았다. 구음장애, 연하곤란을 보였으며, 우측 상지의 근력은 Medical Research Council (MRC) grade 2, 좌측 상지는 grade 4, 양 하지는 모두 grade 3으로 측정되었다. 심부건반사는 전반적으로 감소하였으며, 근위약을 고려하였을 때 소뇌 실조(cerebellar ataxia)는 없었고 수막 자극 징후(meningeal irritation sign)도 없었다.
혈액검사상 aspartate aminotransferase (AST)는 43 IU/L, gamma glutamyl transferase (γ-GT)는 74 IU/L로 약간 상승하였고 혈당은 105 mg/dL이었다. 혈액요소질소, 크레아티닌 수치, 암모니아는 정상이었다. 소변검사상 케톤체가 1+로 관찰되었으며 그 외 특이 소견은 없었다.
뇌 전산화단층활영(computerized tomography, CT)에서 뇌량의 저 감쇠(low attenuation)를 보였으며(Fig. 1A, 1B) MRI의 확산강조영상(diffusion weighted image)에서 뇌량의 무릎(genu), 몸통(body), 뇌량팽대(splenium) 모두에서 고신호강도(hyperintensity)를 보였다(Fig. 1C). 또한 좌측 대뇌피질에서도 고신호 강도가 관찰되었다(Fig. 1D). 액체감쇠역전회복(fluid attenuated inversion recovery, FLAIR)에서는 주로 뇌량의 같은 부위에서 고신호강도를 보였다(Fig. 1E, 1F).
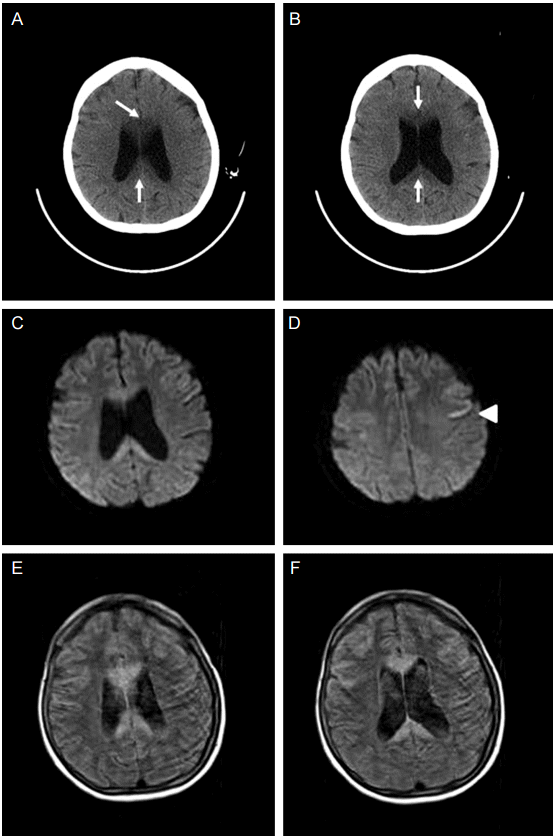
Initial brain imaging of the patient. Computerized tomography (A, B) reveals low attenuation on genu and splenium of the corpus callosum (arrows). Diffusion-weighted image (C, D) demonstrates high signal intensities on the corpus callosum and left frontal cortex (arrow head). On fluid attenuated inversion recovery (FLAIR) image (E, F), signal changes in the corresponding areas are shown.
만성 음주의 과거력과 의식변화, 구음장애, 혼동 등의 중추신경계 증상 및 뇌량의 병변 등을 종합하여 볼 때 MBD에 합당하다고 진단하여 티아민 및 복합비타민의 정맥내 투여를 시작하였다. 이틀 후 환자의 의식은 간단한 명령 시행이 가능할 정도로 다소 호전을 보였으나 구음장애, 연하곤란, 사지 위약감은 변화가 없었다. 이에 덱사메타손(dexathetasone)을 정주로 하루 10 mg 추가하였다. 투약 바로 다음날부터 위약감, 구음장애가 호전되기 시작했으며 스스로 말하기도 증가하였다. 약 일주일 후에는 비위관(Levin tube)을 제거하였고 보조기를 이용하여 보행이 가능해졌으며 2주 후에는 보조기 없이 스스로 보행하였다.
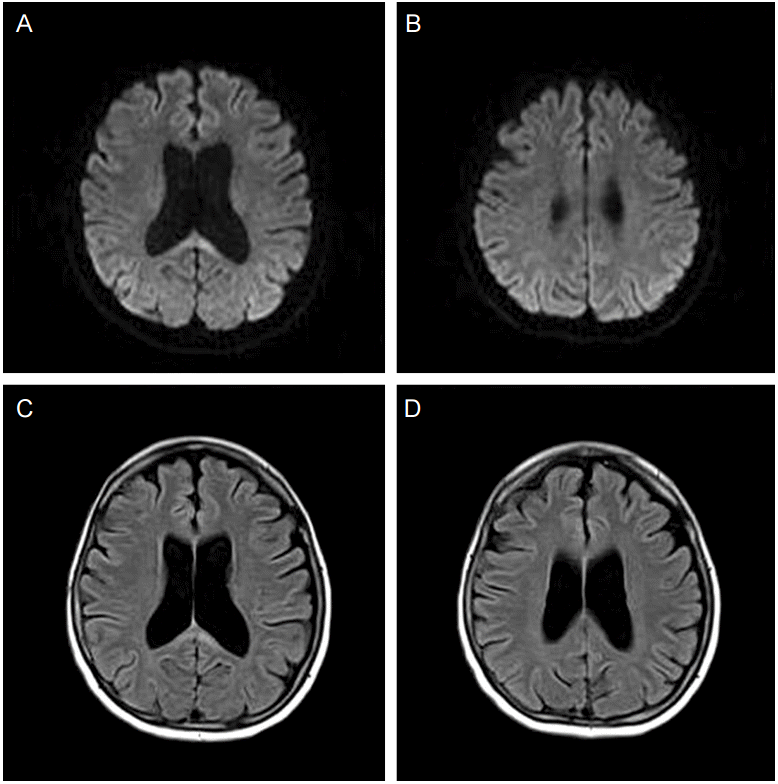
내원 16일에 시행한 신경심리 검사에서 간이정신상태검사(MMSE)는 26점으로 장소지남력에서 1점, 주의집중 및 계산에서 1점, 기억회상 1점, 오각형에서 1점이 감점되었다. 시각적 기억 및 전두엽수행기능(frontal executive function) 장애를 보였으나 언어 기억은 정상 범위였으며 실어증 및 뇌량절단증후군(callosal disconnection syndrome)은 보이지 않았다. 덱사메타손은 총 2주간 투약되었으며 내원 3주 후 시행한 뇌 MRI에서는 뇌량팽대의 일부를 제외한 대부분 영역에서 이전에 보이던 고신호강도가 사라졌다(Fig. 2). 이후 스스로 일상 생활 및 집안일이 가능한 상태로 외래에서 경과 관찰 중이다.
고 찰
MBD는 1903년 병리학자인 Victor와 Ropper [13]가 3명의 알코올 중독 환자에게서 뇌량의 변화를 기술하면서 처음으로 알려지게 되었다. 주로 중년이나 노년의 성인 남자에게 많으며 만성 알코올 중독이나 영양결핍과 관련있다[3,13]. 현미경상에서 병변은 주로 뇌량의 중간층(middle lamina)에 국한되며 수초(myelin)의 손실과 풍부한 대식세포(macrophage), 그리고 별아교세포(astrcyte)의 증식을 관찰할 수 있다[13]. 병리학적으로 뇌량의 탈수초와 괴사를 보이는데, 왜 MBD에서 뇌량의 손상이 발생하는지에 대한 기전은 명확하지 않다[3].
MBD는 뇌 CT에서 뇌량의 저밀도(hypodence) 소견을 보이며, 뇌 MRI는 급성기에서 확산강조영상과 T2 강조영상에서 고신호강도(hyperintence)와 부기(swelling)를 관찰할 수 있으며, 만성기에서는 T1 강조영상에서 동일부위의 저신호강도(hypointence) 및 낭성 변화, 위축 등이 관찰된다[2]. 확산강조영상은 뇌량의 세포독성부종(cytotoxic edema)을 가장 먼저 반영하기 때문에 MBD 진단의 초기지표가 된다[3]. MBD는 뇌량 이외의 부위를 침범하기도 하는데 뇌량과 인접한 백질부위를 침범하거나[13] 대뇌피질 부위를 침범하기도 하며[1], 대체적으로 속섬유막(internal capsule), 대뇌부챗살(corona radiate), 소뇌 등은 보존된다[13]. 병리학적으로 피질 판상 경화증(cortical laminar sclerosis)이라고 하여 전두엽과 측두엽 피질 세번째 층에 있는 신경세포(neuron)들이 사라지고 섬유신경교증(fibrous gliosis)로 대체된다[13]. 어떤 이유로 대뇌피질이 알코올 중독이나 비타민 결핍 등에 취약한지는 명확하지 않지만, 동물실험에서 티아민 결핍이 전두엽 피질의 글루탐산염(glutamate)의 흡수를 감소시키는 것이 관찰되었다[1]. 광범위한 대뇌피질 병변은 나쁜 예후를 야기한다는 보고가 있으며[1], 뇌량외(extracallosal) 병변은 나쁜 예후의 지표가 된다고 보고되었지만 아직까지 논쟁의 여지가 있다[2].
MBD의 치료는 보존적 치료 외에 티아민 투여가 가장 많이 행해지고 있다[3]. 티아민 부족은 수초(myelin sheath)를 감소시키고, 젖산염(lactate)의 침착을 유발하며, 자유 라디칼(free radical)을 생산하여 신경흥분독성(neuroexcitotoxicity)을 일으켜 신경세포의 괴사를 초래한다. 티아민 투여로 이러한 과정을 막는 것이 MBD에서 티아민 치료의 근거이다[14]. 티아민은 증상 발생 2주 안에 투여하는 것이 효과적이며 티아민 치료가 늦어지면 예후가 나빠진다고 알려져 있다[3]. 티아민의 용량은 베르니케 뇌병증의 치료 용량과 동일한 용량이 추천되며, 치료기간은 회복을 보일 때까지 지속하는 것이 추천된다[3].
티아민 결핍 외에 탈수초 및 염증반응이 MBD의 주요 발병기전임을 고려할 때 스테로이드가 효과적 일 수 있다. 2000년에 Kikkawa 등[6]이 처음으로 MBD에서 정맥내 스테로이드 투여로 호전된 사례를 보고한 이후 여러 증례가 보고되었다[3-5,7,8]. 스테로이드는 뇌부종(brain edema)을 감소시키고, 탈수초를 억제한다[3]. 림프구 생성을 억제하고 T세포의 세포자멸사(apoptosis) 및 아라키돈산(arachidonic acid)과 여러 염증물질을 억제하여 염증 반응을 감소시킨다[3,4]. 또한 혈관 투과성(vasogenic permeability) 증가를 줄여 혈액뇌장벽(blood-brain barrier)을 안정시키는 작용을 한다[3]. 일부에서는 티아민에는 반응이 없고 스테로이드 투여 후 뚜렷한 임상호전을 보인 보고들도 있었다[4,5,7].
본 증례의 경우 티아민의 초기 효과는 뚜렷하지 않았으나 정맥내 스테로이드 투여 이후 임상적 호전을 보였다. 또한 내원 당시 심한 신경학적 증상과 함께 뇌량 외 병변을 동반하여 예후가 나쁠 것으로 예상되는 상황에서도 치료 후 경도의 인지저하 외에 신경학적 합병증을 최소화할 수 있었다. 그러나 현재까지 연구에서 티아민의 효과가 나타나는 시점은 불분명하며 상기 환자는 치료기간 대부분에서 티아민과 스테로이드가 동시에 투여되었으므로 스테로이드 단독 효과보다는 두 가지 모두가 임상 경과에 긍정적인 영향을 준 것으로 추정된다.
스테로이드 용량과 기간은 기존 증례들에 의하면 메틸프레드니솔론(methylprednisolone) 500 mg에서 1 g을 5일간 정맥내로 투약하는 충격 요법(pulse therapy)을 주로 사용하였으며[4,5,7] 3주간 투약하기도 하였다[12]. 본 증례에서는 환자가 저 체중이었기 때문에 중간 용량의 스테로이드를 사용하였고 임상경과에 따라 약 2주 정도 투여하였다. 현재 MBD의 스테로이드 치료에 대한 정립된 용법이 없으므로 향후 이에 대한 연구가 필요하다.
현재까지의 연구를 종합해 볼 때 티아민에 비해 스테로이드의 긍정적인 효과가 일관되지는 않다[3]. 다만 증례들에서 스테로이드 투여가 뚜렷한 부작용을 초래하지 않았으며[3] MBD가 다양한 신경학적 합병증을 초래하는 질환임을 고려할 때 티아민 투여 후 임상적 호전이 불분명한 경우 정맥내 스테로이드 치료를 시도하는 것이 환자 예후에 도움이 될 것으로 생각된다.