서 론
스트레스성 심근병증(stress induced cardiomyopathy)은 정신적, 신체적 스트레스에 의해 유발되는 급성 심장질환 증후군으로, 특징적인 좌심실 심첨부(apex)의 운동장애 양상 때문에 Takotsubo 심근병증, 또는 apical ballooning syndrome으로 불리기도 한다. 흉부 통증, 호흡 곤란과 함께 나타나는 심근 효소의 상승, 심근 허혈을 의심하게 하는 심전도의 변화, 심초음파 검사에서 국소벽 운동장애 등 임상 양상은 급성 관상동맥 증후군과 매우 유사하게 나타나지만 관상동맥조영술에서 관상동맥의 유의한 협착이나 파열된 동맥경화반이 존재하지 않는 경우, 임상 양상을 종합적으로 판단하여 스트레스성 심근병증을 진단하게 된다[1]. 진단을 위해서는 관상동맥질환의 배제가 중요하나, 점차 고령의 환자 및 고전적인 관상동맥질환 위험인자를 가진 환자들이 증가하면서 스트레스성 심근병증과 급성 관상동맥증후군의 감별진단이 어려울 때가 많다. 또한 기저 질환의 호전과 더불어 양성경과를 가진다고 알려져 왔지만[2,3], 중환자에서 스트레스성 심근병증이 발생함에 따라 이로 인해 기저질환의 치료가 더 어려워지는 경우도 증가하고 있다. 그리고 스트레스성 심근병증이 처음 정의된 이래, 중환자 관리가 발전하고 과거보다 적극적으로 침습적/비침습적 진단 검사 기법을 활용하게 되면서 스트레스성 심근병증의 유병률 및 진단율이 증가하고 질병의 스펙트럼도 확장되고 있다. 본 지면에서는 스트레스성 심근병증의 유발 요인, 임상 양상 및 감별 진단에 대해 소개하고, 신경과적 중환자에서 발생한 스트레스성 심근병증에 대해 살펴보고자 한다.
본 론
스트레스성 심근병증의 역사와 정의
1990년, 증상과 징후는 급성 관상동맥 증후군과 매우 흡사하면서 관상동맥에 유의미한 협착이나 연축이 관찰되지 않는 환자에 대한 첫 보고가 있었다[4]. 이후 예기치 못한 감정적, 신체적 스트레스 상황을 겪은 후, 좌심실 심첨부에 운동장애가 발생하면서 심첨부가 풍선 모양으로 확장되는 특징적인 운동장애 소견(apical ballooning)과 좌심실 기능저하가 발생하였다가 수주 내에 회복되는 질환 군에 대한 보고가 이어져 왔고, 좌심실 심첨부의 운동장애로 나타나는 모양이 일본에서 문어를 잡을 때 쓰는 항아리와 비슷하다 하여 Takotsubo 심근병증으로 명명되었다[5]. 이후 apical ballooning syndrome, stress-induced cardiomyopathy, broken heart syndrome 등 여러 가지 용어가 사용되어 왔으며, 2006년에 미국심장학회(American Heart Association, AHA)에서 이를 stress cardiomyopathy라 명명하고 후천성 심근병증의 하위 집단으로 분류하였다[6]. 최근에는‘스트레스성 심근병증(stress-induced cardiomyopathy)’이라는 용어가 널리 사용되고 있다. 진단을 위해서는 주로 2004년에 Mayo clinic에서 제시한 항목이 수정 보완되어 사용되고 있다[1]. 이 진단기준을 살펴보면 좌심실의 중간부위에서 심첨부(mid to apical segments)에 일시적인 국소벽 운동장애, 또는 관상동맥의 협착/폐색으로 잘 설명되지 않는 양상의 국소벽 운동 장애가 관찰되고, 심전도 및 심근효소의 변화가 동반되지만 관상동맥에는 유의한 협착이나 동맥경화반의 급성 파열이 확인되지 않는 경우로 정의하고 있다. 또한 임상 연구마다 일부 기준의 차이는 있으나 일반적으로 급성 심근염이 진단되거나, 크롬친화세포종(pheochromocytoma)이 확인된 경우는 스트레스성 심근병증의 진단에서 제외하고 있다.
스트레스성 심근병증의 역학
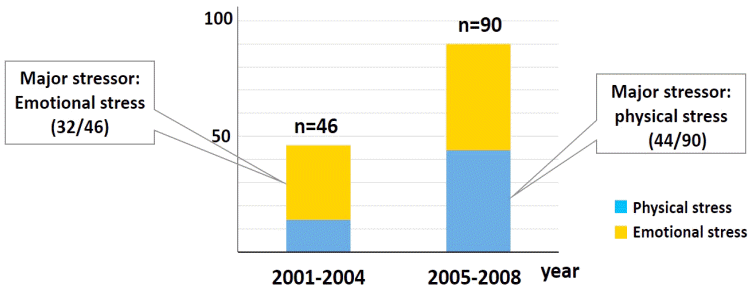
과거 연구들에 따르면 급성 관상동맥 증후군이나 급성 심근경색이 의심되는 환자의 1-2%는 스트레스성 심근병증으로 진단된다고 알려져 있다[7-9]. 하지만 스트레스성 심근병증이라는 질환군이 확립된 지 오래되지 않았으며, 다른 질환을 배제한 후에야 최종 진단이 가능하고, 또 진단 과정에 대한 지침이 확립되지 않았기 때문에 스트레스성 심근병증의 정확한 발생률을 집계하기 어려운 면이 있다. 그럼에도 불구하고 스트레스성 심근병증의 발생률 및 진단율이 증가하고 있다는 것은 분명해 보이는데, Sharkey 등[10]의 보고에 따르면 약 7.4년 동안 단일 센터에서 136명의 스트레스성 심근병증 환자를 전향적으로 등록하여 연구를 진행하였는데 초기 3.6년보다 후기 3.8년에 등록된 환자가 통계적으로 유의하게 많았다(Fig. 1). 또한 주된 유발요인이 감정적 스트레스에서 신체적 스트레스로 변화되는 양상을 보였다[10]. 실제 진료 현장에서도 기저 질환이 많은 고령 환자에게 다양한 내과적 중재 시술, 외과적 수술이 적극적으로 시행되면서, 중환자에서 발생하는 신체적 스트레스에 의한 스트레스성 심근병증의 유병률이 증가 추세를 보이고 있다. 따라서 순환기내과뿐만이 아니라 다양한 의학 분야에서 스트레스성 심근병증에 대한 깊은 이해가 요구되고 있다.
스트레스성 심근병증의 임상적 특징 및 진단
기존 보고에 따르면 스트레스성 심근병증의 80-90% 이상이 폐경기 이후 여성에게서 발생한다고 알려져 있다[1,11,12]. 하지만 국내 연구들에 따르면 스트레스성 심근병증에서 남성 환자의 비율이 30% 이상으로, 기존 연구들에 비해 남성의 비율이 높게 보고되고 있다[13,14]. 특히 중환자실 환자만을 대상으로 한 연구의 경우, 남성 환자의 비율을 65%로 매우 높게 보고한 바 있다[15]. 발병 연령의 분포는 10-91세까지 광범위하나, 주로 60-75세에서 발병하는 것으로 보고되고 있다[11,12,16]. 환자들은 고전적인 관상동맥 위험인자를 함께 가진 경우도 많아 급성 관상동맥 증후군과의 감별이 더욱 어려울 때가 많다[11,17,18].
1) 유발 요인(stressor)
스트레스성 심근병증은 질환의 명명에서도 볼 수 있듯이 선행되는 스트레스 상황(stressor)이 있는 것이 그 특징이다. 유발요인은 연구마다 다양하게 보고하고 있지만 일반적으로 감정적 요인(30%), 신체적 요인(40%), 유발 요인이 뚜렷하지 않은 경우(30%)로 나누어진다고 보고되고 있다(Table 1)[1,11,12]. 질환이 보고되고 초기에는 전형적으로 중년 여성에서 감정적 스트레스에 의해서 스트레스성 심근병증이 유발된다고 알려졌으나, 최근 보고들에 따르면 신체적 스트레스로 인한 발병이 증가하고 있으며[10], 실제로 국내 3차 병원 환자를 대상으로 한 연구 결과는 신체적 스트레스로 인한 발병이 65-80%라고 보고하고 있다[14,16]. 대표적인 신체적 유발요인은 급성 호흡 부전(18-26%), 수술이나 시술(14-21%)이 있고, 2-7%는 뇌졸중, 뇌전증과 같은 신경과적 질환에 의해 발생하기도 한다[10,11].
3) 심전도(electrocardiogram, ECG)
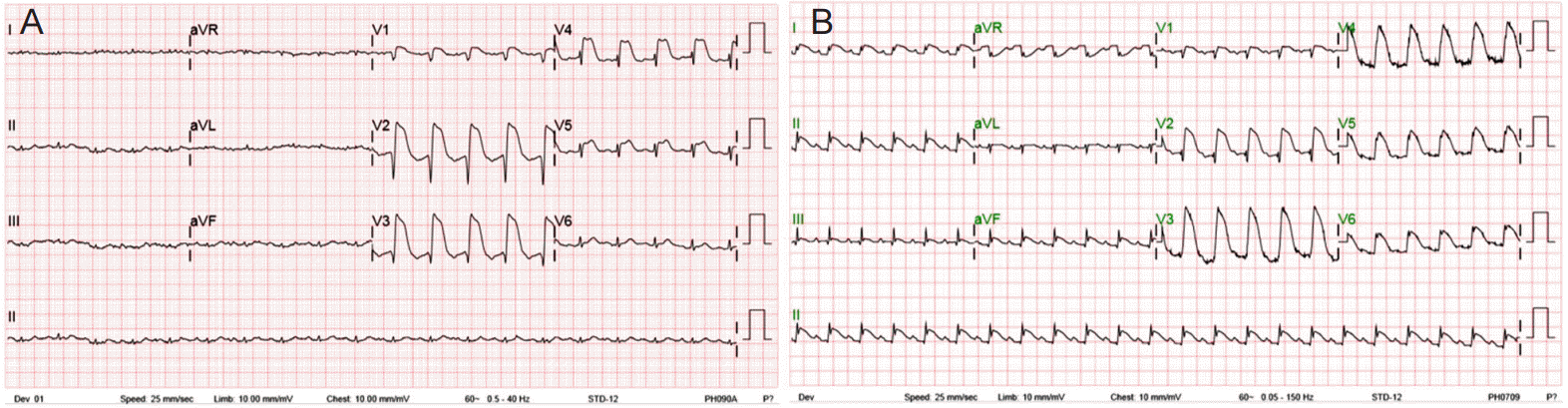
스트레스성 심근병증 환자에서는 다양한 심전도 변화를 관찰할 수 있다. 가장 흔한 변화는 ST 분절의 상승으로 40-80%의 환자에서 ST 분절의 상승이 관찰된다고 알려져 있다[3]. T 파의 역전도 흔히 관찰되며 약 65%의 환자에서 관찰된다고 보고된 바 있다[3]. 이 같은 심전도 변화는 전흉부 유도에서 주로 관찰되지만, 하벽이나 측벽의 심근경색을 시사하는 소견으로 나타날 수도 있다(Fig. 2)[3,7,19]. 이 밖에도 ST 분절 하강, Q파, 새롭게 발생한 좌각차단이 관찰될 수 있으며, QT 연장, 고도 방실 차단, 심실상성 빈맥, 심방 조동/세동, 심실 빈맥/세동 등 다양한 부정맥 또한 동반되기도 한다[3,18,20].
4) 심근 효소(cardiac biomarkers)
급성 관상동맥 증후군이나 급성 심근염에서와 마찬가지로 스트레스성 심근병증에서도 심근 효소의 상승이 관찰된다. 스트레스성 심근병증으로 확진된 환자의 70-80%에서 Creatinine kinase (CK), creatinine kinase-MB (CK-MB)와 troponin I, T의 상승이 확인된다[3,21,22]. 일반적으로 심근효소 수치는 24시간 이내에 최고치에 도달하며, 상승폭은 ST-분절 상승 심근경색(ST elevation myocardial infarction, STEMI)에 비해 적고, 또 심초음파에서 관찰되는 국소벽 운동장애의 범위에 비해 적은 것이 특징이다[1]. 이에 Ramaraj 등[23]은 114명의 스트레스성 심근병증 환자를 분석하여 troponin I의 최고치가 15 ng/mL를 초과할 경우 스트레스성 심근병증으로 진단하는 것이 적절하지 않겠다는 의견을 제시하기도 하였다. 하지만 기존 연구에서 제시된 값은 심근경색 재관류 이후의 심근 효소치가 포함되어 있어 실제 관상동맥조영술로 심근경색과 스트레스성 심근병증을 감별하기 이전의 수치를 비교한 것이 아니라 결과 해석에 주의가 필요하다. 또한 급성심근경색과 스트레스성 심근병증을 감별할 수 있는 정확한 기준 값이 확립된 것이 아니기 때문에, 실제 임상에서 심근 효소 상승폭을 근거로 개개의 환자를 급성 관상동맥 증후군과 감별 진단하기에는 어려움이 있다.
5) 심초음파 소견(echocardiographic findings)
스트레스성 심근병증에서 관찰할 수 있는 심초음파 소견은 매우 다양하다. 고전적으로는 좌심실 심첨부(apex)나 중간 부분(mid-ventricle), 혹은 둘 다를 침범하는 국소벽 운동장애가 주로 기술되었지만, 심첨부 운동은 유지되면서 중간 부분의 국소벽 운동장애만 보이는 경우(mid-ventricular variant), 심첨부에서 중간 부분의 운동은 유지되면서 기저부만을 침범하는 경우(inverted or reversed variant)도 보고되었다. 또한 관상동맥질환으로 설명되지 않는 국소벽 운동이상이나 전벽의 수축력 감소(global hypokinesia) 등의 다양한 형태로 나타나기도 한다[13,24]. 우심실 기능 장애가 발생하는 경우도 있는데 많게는 50%까지 보고되고 있으며, 이 중 1/4은 우심실 심첨부 운동장애로 나머지 3/4는 우심실 전반의 운동저하를 보인다[25]. 고령이거나 좌심실 수축 기능 저하가 심한 경우 우심실 침범이 더 빈번하게 관찰되었는데, 우심실 기능이 저하되어 fractional area change (FAC)가 35% 미만으로 측정될 경우 사망률이 유의하게 높았다[25].
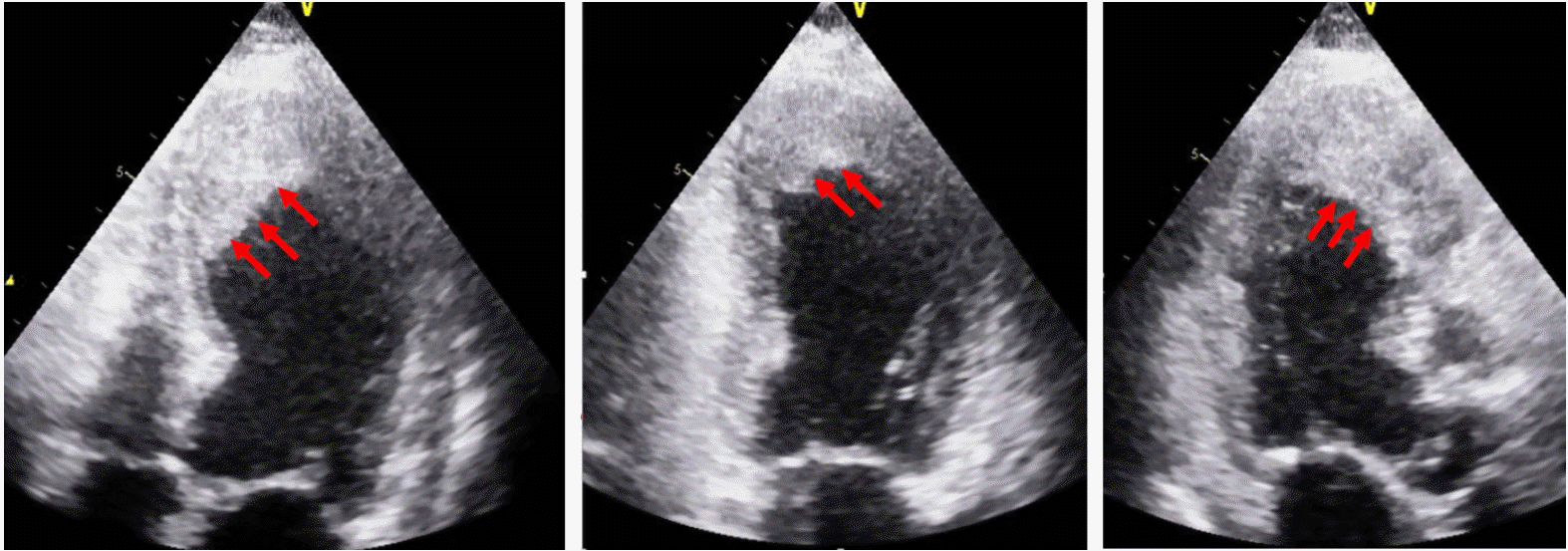
심초음파 검사는 이러한 심근벽 운동장애 양상을 확인하는 것뿐만 아니라 스트레스성 심근병증에서 나타날 수 있는 합병증의 발견, 진단에도 중요한 역할을 한다. 좌심실 심첨부 혈전(LV apex thrombus) (Fig. 3)이나 승모판 역류(mitral regurgitation), 심낭 삼출(pericardial effusion) 등이 발생되었을 경우 이를 조기 발견하여 치료에 도움을 줄 수 있다. 예를 들어 스트레스성 심근병증 환자가 혈압이 지속적으로 낮은 경우에는 심한 좌심실 기능의 저하 이외에도 동적 좌심실 유출로 폐색(dynamic LV outflow tract obstruction)의 발생을 의심하고 심장초음파 검사를 시행하는 것이 추천되고 있다[2,16,26].
6) 관상동맥질환을 배제하기 위한 다양한 진단적 검사들
스트레스성 심근병증을 진단하기 위해서는 관상동맥질환이 배제되어야 한다. 일반적으로 관상동맥조영술을 시행하여 유의한 협착 및 파열된 동맥경화반이 없는 것을 확인하고 급성 관상동맥 증후군을 배제한다. 관상동맥에 유의한 협착 병변이 관찰되지 않더라도 혈관 연축으로 인한 이형협심증의 가능성도 있기 때문에 환자가 안정적이라면 혈관 연축 유발검사를 해볼 수도 있다. 스트레스성 심근병증의 확진을 위해 관상동맥조영술은 필수적인 검사이지만 중환자실 입원 환자의 경우 여러 가지 이유로 침습적인 관상동맥조영술을 시행하지 못하는 경우가 있다. 국내에서 시행된 관찰연구에 따르면 스트레스성 심근병증이 의심되는 56명의 환자 중 19명(34%)이 기계 환기 중이어서, 침습적 검사가 금기로 판단되어서, 전신 상태가 좋지 않아서, 또는 이미 좌심실 기능이 완전히 회복되었다는 이유로 관상동맥조영술을 시행하지 않았다[16]. 침습적 관상동맥조영술을 시행하기 어려운 경우 심장 단층촬영(computed tomography, CT)으로 비침습적으로 관상동맥질환을 배제하거나[27-29], 일정 시간이 경과한 뒤 심초음파를 반복 시행하여 국소벽 운동장애가 회복되는지를 확인하여 진단에 도움을 얻을 수도 있다. 또한 경우에 따라 핵의학적 검사를 시행해볼 수도 있다.
관상동맥이 정상으로 확인된 경우에도 환자의 임상 양상과 국소벽 운동장애의 가역성 등을 종합적으로 판단하여 스트레스성 심근병증 이외의 원인 감별을 위해 심장 자기공명영상(magnetic resonance imaging, MRI)을 시행할 수도 있다. 일반적으로 스트레스성 심근병증은 급성기에(72시간 미만) Cine MRI에서 심초음파 검사와 일치하는 국소벽 운동장애를 보이고, T2 강조영상에서 해당부위의 심근부종이 관찰된다고 알려져 있다[30]. T2 강조영상에서 관찰되는 심근부종의 범위는 혈청 normetanephrine 및 N-terminal pro-brain natriuretic peptide(NT-proBNP) 최고치와 상관관계가 있다고 보고된 바 있다[30]. 지연조영증강(late gadolinium enhancement, LGE)-MRI에서 비가역적 심근손상을 시사하는 LGE는 관찰되지 않는다고 알려져 왔으나[31], 최근 스트레스성 심근병증에서도 LGE 소견이 관찰되기도 한다는 보고도 있다[32,33]. 스트레스성 심근병증에서 관찰되는 LGE 소견은 심근 경색이나 급성 심근염에서의 LGE 소견과 달리 신호증강 정도가 약하고, LGE의 범위가 국소벽 운동장애와 부종을 보이는 범위보다 작고, 12개월 내에 소실된다는 특징이 감별점으로 제시되고 있다[32,33].
스트레스성 심근병증의 병인
스트레스성 심근병증의 원인에 대해서는 여러 가지 가설이 있지만 카테콜아민의 갑작스러운 증가로 인한 심근의 기절(stunning)이 주요 기전으로 생각되고 있다[34]. 스트레스 상황에서 혈중 카테콜아민이 상승하면서 베타-2 아드레날린수용체를 통해 Gs 단백질이 Gi 단백질로 변환되고, 이는 심근 세포자멸사를 촉진하는 역할을 하는 베타-1 아드레날린 수용체의 활성화를 막아 심근을 보호하는 효과가 있지만 동시에 심근 수축력을 감소시킨다. 그런데 상대적으로 베타 아드레날린 수용체의 밀도가 높은 심첨부에 이 같은 효과가 가장 크게 나타나서 스트레스성 심근병증에서 전형적인 심첨부의 국소벽 운동장애가 나타난다고 추정하고 있다[1,2]. 실제로 크롬친화세포종(pheochromocytoma) 환자에서 카테콜아민에 의해 유발되는 심근병증에서 스트레스 심근병증에서 관찰되는 전형적인 심첨부의 운동장애가 관찰됨이 잘 알려져 있다[35,36]. 또한 최근 스트레스성 심근병증 환자에서 123I-Metaiodobenzylguanidine(MIBG)를 이용해 심근의 교감신경 기능을 평가해본 연구에서 심근에서 국소벽 운동 장애를 보이는 부위와 교감 신경 기능 장애를 보이는 부위가 일치하였다[37].
하지만 일부 연구자들은 혈중 카테콜아민 농도 상승이 스트레스성 심근병증 환자에서만 나타나는 특징적인 소견이 아니라는 점[38], 스트레스성 심근병증에서는 카테콜아민 유발 심근병증에서 전형적으로 관찰되는 병리소견인 contraction band necrosis가 관찰되지 않는다는 점 등을 근거로 두 질환의 병인기전이 완전히 동일하지 않다고 제시하고 있다[1,5]. 혈관 연축, 내피세포나 미세혈관의 기능 이상, 내분비계나 중추신경계의 스트레스에 대한 과반응 혹은 이상반응 등이 추가적인 기전으로 제시되고 있다[5]. 또한 스트레스성 심근병증의 주요 유발 요인 중 하나인 심한 감염증이나 패혈증에서의 스트레스성 심근병증은 ‘패혈증유발 심근병증(septic cardiomyopathy)’으로 분류되기도 하며 스트레스성 심근병증과는 다른 질환 혹은 하위 집단으로 생각된다[39]. 가역적인 좌심실 기능저하를 동반하며 수액 공급에도 잘 반응하지 않는 혈압저하 및 혈중 카테콜아민 상승에 심박출량(cardiac output)이 증가하지 않는 소견을 보인다. 패혈증유발 심근병증은 세포 칼슘 대사의 항상성이 손상되거나 산화인산화 과정의 문제가 병인 기전으로 연구되고 있다[39,40].
스트레스성 심근병증의 치료
현재 스트레스성 심근병증에 특화된 치료 방침이 정립되어 있지는 않으며, 기저 질환의 치료와 병행하여 일반적인 급성 심부전 치료를 시행하는 것이 일차 치료이다. 혈압이 안정적이면서 울혈이 동반된 경우 이뇨제를 투여할 수 있고, 좌심실 기능이 회복될 때까지 심부전에 준하여 베타차단제, 앤지오텐신전환효소억제제, 앤지오텐신수용체차단제를 투여해볼 수 있다[2]. 혈역학적으로 불안정할 경우에는 심근수축 촉진효과를 가지는 정맥제제를 투여하여 혈압을 유지하거나 대동맥내 풍선펌프를 삽입하기도 한다[2].
스트레스성 심근병증의 가장 흔한 합병증은 심부전이며, 보고에 따라 다르지만 약 15-50%의 환자에서 심부전의 증상 및 징후가 관찰된다[3,12]. 심부전으로 인해 심장성 쇼크(9.3%), 폐부종(25%)이 발생하며, 치명적 부정맥(4.2%)이 발생하기도 한다[41]. 이 밖에도 승모판 역류, 심낭 삼출, 동적 좌심실 유출로 폐색이 발생할 수 있으며, 심첨부 혈전이 형성될 수 있고 이로 의해 혈전색전증이 발생하기도 한다(Fig. 3). Mitsuma 등[42]의 소규모 보고에 따르면 21명의 스트레스성 심근병증 환자 중 11명(52%)에서 심부전이 가장 흔한 합병증으로 확인되었으며, 3명(14%)의 환자가 급성 경과 중 혈전색전증이 진단되어 두 번째로 흔한 합병증을 혈전색전증으로 보고하였다. 혈전색전증이 진단된 세 명 중 한 명은 좌심실 내 혈전이 발견되었고, 나머지 두 명은 다른 심장성 혈전에 의한 뇌졸중이 진단되었다. 이 때문에 스트레스성 심근병증의 경과 중 항응고 치료가 필요하다는 주장도 있으나 아직까지 이에 대한 진료 지침이 확립되지는 않았다.
스트레스성 심근병증의 예후
스트레스성 심근병증은 일반적으로 수일에서 수주가 경과하면 호전되는 경과를 보인다. 국소벽 운동장애는 보통 4-8주 경과되면 완전히 호전되며, 추적 관찰 심초음파 검사에서 지속적으로 국소벽 운동장애가 관찰된다면 다른 진단의 가능성을 염두에 두고 재평가해야 한다[1,3]. 초기 심장 MRI에서 운동장애 부위에 LGE 소견이 관찰된다면 국소벽 운동장애가 정상화가 지연된다는 보고도 있다[33].
임상적으로 스트레스성 심근병증은 입원 중 사망률이 1-2% 정도로 양성 경과를 보인다고 알려져 있으나, 최근 보고된 메타 분석(meta-analysis)에서는 입원 중 사망률을 3.5-4.5%로 보고하였다[12]. 중증도가 높은 환자들을 대상으로 한 연구에서는 입원 중 사망률을 16%까지도 보고하고 있어 기저질환의 중증도가 높거나 스트레스성 심근병증이 질병 경과에 악순환으로 작용하는 경우 예후가 좋지 않다고 생각되고 있다[16]. 스트레스성 심근병증에서 사망은 주로 심한 심부전으로 인한 심장성 사망이었으며, 심장성 사망에서 두 번째로 흔한 원인은 치명적 부정맥의 발생으로 인한 사망이었다. 심장성 사망 이외에는 기저 질환의 진행이나 다기관 기능부전이 주된 사인이었다[17]. 스트레스성 심근병증에서 acute physiology and chronic health evaluation (APACHE) II score, 1주일 내에 좌심실 기능의 회복 여부가 주요 예후 예측인자로 보고된 바 있다[16].
신경과적 특수 상황에서의 스트레스성 심근병증
스트레스성 심근병증이 기술되기 이전부터 급성 지주막하출혈 환자에서 심근 손상이 동반된다는 보고가 있었다[43,44]. 급성기의 지주막하출혈 환자 50-100%에서 심전도의 ST 분절, T 파, QT간격의 이상소견이, 20-40%에서 심근 효소의 상승이 동반된다고 보고되었다[45]. 심초음파 검사에서는 스트레스성 심근병증과 마찬가지로 가역적인 좌심실 수축력의 이상이 확인되었으며, 관상동맥은 정상으로 확인되었다. 이들 환자를 대상으로 한 부검 연구에서는 심근에 contraction band necrosis가 보고되었는데[45], 앞에서 언급하였듯이 이는 일반적인 스트레스성 심근병증이 아니라 카테콜아민 유발 심근병증에서 관찰되는 소견이다. 따라서 미국 뇌졸중 학회(American Stroke Association)에서는 1990년 이를 지주막하 출혈 후 카테콜아민 독성에 의해 발생하는 가역적 신경성 심근 기절(neurogenic myocardial stunning)로 정의하였으며[45], 스트레스성 심근병증의 진단기준에 따라 크롬친화성세포종과 함께 지주막하출혈로 인한 심근병증 역시 스트레스성 심근병증 진단의 제외 기준으로 삼고 있기도 하다. 하지만 이들 질환 모두가 병인을 상당부분을 공유하고 있으며, 비슷한 임상 경과를 보일 뿐만 아니라 동반되는 합병증 역시 매우 유사하며, 스트레스성 심근병증과 마찬가지로 특이적 치료방침이 확립되어 있지는 않다[2,46]. 급성 지주막하 출혈에 의한 심근 기절의 경우 Troponin I가 높을 수록 합병증의 위험도가 증가하고 지연성 뇌허혈, 사망, 퇴원 시 기능 회복 정도와 연관이 있음이 보고되었다[47].
급성 지주막하 출혈에 의한 심근기절을 제외한 다양한 신경과적 질환들이 스트레스성 심근병증을 일으킨다고 보고되고 있는데, 뇌전증과 뇌졸중 역시 스트레스성 심근병증의 유발요인의 하나로 약 2-7%를 차지한다[10,11]. Sharkey 등의 연구에서 136명의 스트레스성 심근병증 환자 중 57명이 신체적 스트레스에 의한 발병이었고 이 중 10명이 지주막하 출혈, 뇌타박상, 뇌동맥류 출혈, 혈관염, 편두통, 뇌전증, 뇌 농양 등과 같은 신경학적 질환으로 보고되었다[10]. Eitel 등[11]의 연구에서는 총 256명의 스트레스성 심근병증 환자 중 105명을 신체적 스트레스에 의한 발병으로, 이 중 4명이 뇌졸중, 2명이 뇌전증이 유발요인이었다고 보고하였다. 국내 3차 병원 입원환자를 대상으로 한 단일 센터 연구에서 보고된 바에 따르면 56명 중 1명이 허혈성 뇌졸중에 의한 스트레스성 심근병증이었다[16]. 이처럼 보고에 따라 신경과 질환에 의한 스트레스성 심근병증의 빈도가 다양한 것은 급성 지주막하 출혈 등을 포함하는지가 연구에 따라 달랐으며, 또한 기저질환은 신경과 질환이지만 결국 경과 중 급성 호흡 부전이나 흡인성 폐렴, 패혈증 등이 동반되면서 스트레스성 심근병증이 유발되었을 때 유발 요인을 어떤 질환으로 판단했는지에 따라 달라졌기 때문으로 생각된다. 신경과 질환의 중환자 치료가 발전하고 있는 것을 고려할 때 신경과 질환자에서의 심근병증에 대한 추가 연구가 필요하며, 미래의 연구들은 어떤 신경과 질환에서 스트레스성 심근병증이 호발하는지, 신경과 질환자에서의 스트레스성 심근병증의 임상적 특이성이 있는지, 또 그래서 특이적인 치료가 필요한 지에 대한 답을 줄 수 있어야 할 것으로 생각된다.
결 론
스트레스성 심근병증이 처음 정의된 이래, 중환자 관리가 발전하고 과거보다 적극적으로 다양한 진단 검사를 활용하게 되면서 스트레스성 심근병증의 진단율이 증가하고 질병의 스펙트럼도 확장되고 있다. 스트레스성 심근병증은 기저 질환의 호전과 더불어 양성경과를 가진다고 알려져 왔지만, 중환자에서 스트레스성 심근병증이 발생하는 경우 이로 인해 기저질환의 치료가 더욱 어려워지거나 사망하는 경우도 증가하고 있다. 따라서 스트레스성 심근병증은 환자의 증상과 징후를 통해 초기에 발견하고, 급성 관상동맥 증후군 등의 교정 가능한 원인을 감별해내는 것이 중요하며, 임상 양상뿐 아니라 환자가 가진 위험 인자, 다양한 전신 질환 및 심혈관 상태를 고려하여 종합적으로 접근하는 자세가 필요하다.