서 론
급성 대동맥박리은 전형적으로 심한 가슴 통증이나 등부위 통증으로 나타나며, 보고에 따라 다양하나 17%-40%의 경우 신경학적 증상이 동반되는 경우도 있다[1]. 대개 대동맥에서 분지하는 경동맥이나 척추동맥, 척수 동맥의 폐색이나 전신적인 저혈압으로 인한 대뇌 관류저하로 인해 뇌경색, 저산소성 뇌병증, 척수 경색, 경련 및 실신, 허혈성 말초신경병증 등이 발생할 수 있다[1]. 특히 전형적인 통증이 없이 신경학적 증상만 초기에 나타나는 경우 대동맥박리의 진단이 지연될 수 있으며, 발병 시간과 신경학적 증상의 중증도를 고려하여 혈전 용해술의 적응증이 되는 경우 대동맥박리을 인지하지 못하고 혈전 용해제가 투여될 수 있다[2]. 저자들은 전형적인 통증 없이 갑자기 발생한 경련 발작 및 의식 저하, 우측 대뇌 반구 기능 저하 증상을 주소로 내원하였고, 대동맥박리에 동반된 혈관벽 내 혈종으로 인한 우측 총경동맥의 압박과 이로 인한 우측 대뇌의 관류저하가 영상학적 검사로 확인된 환자를 조기에 진단하여 적절한 치료를 통해 신경학적 후유증 없이 회복된 경험을 하였기에 보고하는 바이다.
증 례
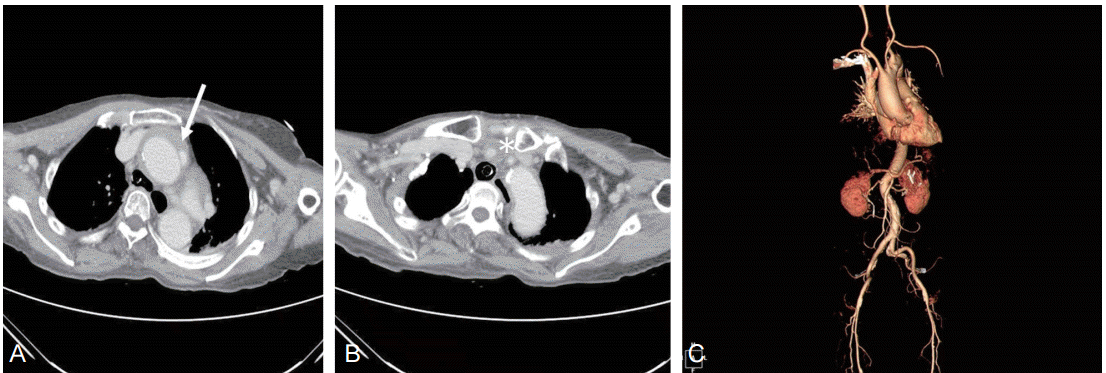
77세 여자 환자가 갑자기 발생한 두통을 동반한 양팔과 다리의 경련 및 의식 저하를 주소로 응급실로 내원하였다. 고혈압 외 특이 병력 없었던 환자로 내원 당일 오전 8시 30분경 양치질 하던 중 갑자기 아래턱 통증과 함께 두통을 호소하기 시작하였다. 전신 위약감으로 인해 소파에 앉아서 쉬던 중 양팔과 다리의 경련성 움직임과 함께 의식 저하 및 구토 증세가 발생하기 시작하였다. 오전 9시경 응급실 내원 당시 우측 안구 편위와 함께 좌측 팔, 다리의 편마비(Medical Research council grade I) 및 감각 저하, 좌측 안면 마비 증세가 있었고 간헐적으로 1분 미만으로 지속되는 우측 팔, 다리의 근간대성 경련이 동반되었다. 당시 우측 상지에서 측정한 혈압이 56/48 mmHg, 심박수 43회/분으로 측정되어 도파민을 5 mcg/kg/min으로 정맥 주입하기 시작하였고, 아트로핀 0.5 mg을 한차례 정주하였으며 혈압은 평균 동맥압 65 mmHg 이상으로 상승하였다. 좌측 상지와 의미 있는 혈압 차이는 없었다. 이후 의식의 회복 없이 전신 근간대성 경련이 다시 발생하여 뇌전증 지속증 가능성 고려하에 로라제팜 2 mg을 정맥 투여하였다. 로라제팜 투여 후 산소 포화도가 80%대로 저하되어 오전 9시 25분 응급으로 기관내삽관 후 기계 환기를 적용하였다. 신경학적 증상이 처음 발생한 후 55분 가량 소요된 상태로 정맥내 혈전용해 치료의 적응증이 될 것으로 판단되어 응급으로 뇌혈관을 포함한 전산화단층촬영 및 관류영상검사를 시행하였고 동시에 뇌파검사를 진행하였다. 뇌파검사에서 우측 전두엽 부위 간헐적인 서파 외에 간질파는 관찰되지 않았다. 뇌혈관 전산화단층촬영 검사에서 상행 대동맥의 국소 내막 파열을 동반한 박리와 함께 상행 대동맥과 대동맥활에 걸쳐 혈관벽 내 혈종이 관찰되었고, 이로 인해 우측 총경동맥이 압박되고 있었다(Fig. 1). 대뇌 혈관의 협착이나 폐색은 없었으며 뇌관류 전산화 단층 영상에서 우측 대뇌 반구 전체에 걸쳐서 전반적인 최고농도시간(Time to peak, TTP)과 평균 통과 시간(Mean transit time, MTT)이 연장되어 있었다(Fig. 2A). 흉부 X선 검사에서 종격의 확장은 없었고 심전도는 정상 리듬이었으며 심장앞 유도에서 V2에서 V6에 걸쳐 T파의 역위가 있었다. 대동맥박리로 인해 정맥내 혈전 용해술을 시행하지 못하였고 뇌경색 및 뇌출혈 유무를 확인하기 위해 시행한 뇌자기공명영상에서는 급성기 뇌경색이나 출혈은 없었다(Fig. 2B). 이에 환자는 즉시 흉부외과로 전과되어 응급으로 상행 대동맥과 대동맥 궁을 포함하여 인조 혈관 치환술을 시행받았다. 수술후 1일째 환자는 투여중인 통증 조절 약제 및 진정제로 인해 기면 상태였으나 통증 자극 시 회피 반응이 양측 상하지에서 동등하게 관찰되었고 좌측의 심부 건반사 항진이나 바빈스키 반사등 상부 운동신경 및 편측화 징후는 없었다. 수술 후 2일째 환자는 명료한 의식 상태를 회복하였고 신경학적 증세 없는 상태로 일반 병실로 전동되었고 수술 5일째 특별한 후유증 없이 집으로 퇴원하였다.
고 찰
대동맥박리은 백만명당 연간 5-30예 정도의 발생빈도를 보이며[3] 최근 국내에서도 발생빈도가 크게 증가하고 있다[4]. 상행 대동맥이 침범된 Standford A형 급성 대동맥박리은 전체 대동맥박리의 80% 정도를 차지하고 있고 내과적 치료로 2주내 사망률이 80%를 넘기 때문에 수술적인 치료가 원칙이며, 국내에서 연간 300명 이상의 환자에서 수술이 시행되고 있다[4]. 대동맥 벽 내 혈종은 대동맥박리의 5%-17%에서 동반되며[5] 작은 맥관벽혈관(vasa vasorum)이 파열되고 이로 인해 혈관벽 내 혈종이 차게 되는데, 상행 대동맥을 침범한 혈종의 경우 일반적인 대동맥박리과 비슷한 예후를 보인다[6]. Standford A형 급성 대동맥박리 환자의 10%에서 전형적인 흉통 증상 없이 신경학적 결손만을 나타내는 경우가 있는데, 증상 발생 시간이 얼마 되지 않아 내원한 경우 대동맥박리에 대한 진단을 하지 못하고 정맥내 혈전 용해제가 투여되었던 경우가 있다[2,7].
본 증례의 초기 뇌관류 전산화단층영상에서는 우측 대뇌반구의 관류저하가 명확하나 뇌자기공명영상의 확산강조영상(diffusion weighted image)에서는 아직 허혈성 뇌병변이 발생하지 않은 상태였다. 일반적인 급성기 경동맥폐색으로 인한 뇌경색에서와 같이 비가역적인 뇌세포 손상(ischemic core)이 발생하지는 않았으나, 관류저하로 인해 자동 조절능력이 소실된 허혈성 반음영(penumbra)이나 양성 혈량감소 영역(benign oligemia) 상태였을 것으로 생각된다. 허혈성 반음영은 뇌 혈류량이 감소되어 있으나 산소 추출능(oxygen extraction ration)이 최대한 증가되어 있어 산소 대사량은 유지가 되는 상태로, 조직 손상은 발생하지 않았으나 기능 저하가 동반되고 혈류 저하 지속 시 비가역적인 손상이 발생할 위험성이 높은 영역을 의미한다[8]. 양성 혈량감소는 비교적 혈류 감소 정도가 경미하여 영구적인 손상의 위험이 없이 저절로 회복될 수 있는 부위이다[8]. 그러나 양성 혈량감소 영역도 전신적인 저혈압이나 두개내 고혈압, 고혈당증 등의 이차적인 원인에 의해 허혈성 반음영으로 전환될 수 있다[8]. 따라서 대동맥박리 및 이로 인한 혈관벽 내 혈종이 대뇌를 공급하는 동맥을 압박함으로써 뚜렷한 임상 증상을 나타내고, 관류 영상에서 명백한 대뇌 관류저하가 관찰되는 경우에도 응급 수술을 시행하여 신경학적인 후유증을 최소화하기 위한 노력은 중요하다.
본 증례에서 나타난 환자의 의식 저하와 동반된 좌측 팔, 다리의 근 간대성 경련이 과연 뇌전증 지속 상태로 인한 증상이었는지에 대해서는 재고해 볼 필요가 있다. 로라제팜의 정맥내 투여가 대동맥박리에 의한 혈압저하 및 대뇌 관류저하를 악화시켰을 가능성이 있고, 의식 상태의 악화, 자발호흡 억제로 인한 산소포화도 저하가 기관 삽관의 원인이 되었을 가능성이 높아 초기에 경련증상을 보이는 환자가 왔을 때 정확한 감별 진단이 중요하다. 대뇌 관류저하로 인한 무산소 발작(reflex anoxic seizure)에서도 70%-90%에서 팔다리와 몸통의 근간대성 경련이나 몸통의 강직폄, 얼굴 단일 수축 등의 경련성 움직임이 나타날 수 있으며[9] 본 증례에서는 좌측 팔, 다리의 편마비로 인해 우측에서만 증상이 두드러지게 나타났을 것으로 생각된다. 또한 우측 대뇌 허혈로 인한 좌측 팔, 다리 마비와 감각 저하, 좌측 안면 마비가 동반되어 있는 환자에서 안구 편위의 방향이 우측이었다는 점도 증상의 원인을 감별하는데 도움이 된다. 기저핵 (basal ganglia), 전두 안구 영역(frontal eye field), 두정 안구 영역(parietal eye field) 및 공간 주의력과 관련된 측두 두정엽 피질이 동향성 안구 편위에 관여하게 되는데[10] 이러한 부위가 뇌전증으로 인한 과흥분 시 반대측으로 안구 편위가 일어난다는 점을 고려하면 병변 측으로의 안구 편위는 뇌전증보다는 관류저하로 인한 기능저하로 판단할 수 있다. 이후 시행한 뇌파검사에서도 우측 대뇌에 국한된 느린 파형 이외에 뇌전증을 시사할 만한 파형은 관찰되지 않았다. 그러나 실신의 일종인 무산소 발작이 뇌전증을 유발할 수 있으며[11] 로라제팜의 투여로 인해 뇌파검사에서 뇌전증 파형이 소실되었을 가능성도 전혀 배제할 수는 없다.
대동맥박리 환자에서 드물게 전형적인 통증 없이 신경학적 증상으로만 발현하게 되는 경우가 있는데, 4.5시간 이내에 내원하였고 비교적 심한 신경학적 결손 증상을 나타내는 경우 대동맥질환을 인지하지 못하고 정맥내 혈전 용해제가 투여되게 되면 심낭 압전이나 종격 출혈, 대동맥기시동맥폐색으로 인한 괴사 등 치명적인 결과를 초래할 수 있다[12,13]. 이를 방지하기 위해 신체검사를 통해 연속적인 맥박 측정 및 소실 여부 관찰, 양팔 혈압 측정 및 차이 비교, 심청진상 대동맥 판막부전을 시사하는 심잡음이 청진되는지 확인해야 한다[14]. 흉부 X선 검사를 통해 종격의 확장 유무에 대한 평가, 심전도를 통한 심근경색 동반 유무에 대한 확인이 선행되어야 한다[14]. 본 증례의 경우 이학적 검사에서 대동맥박리을 의심할 만한 이상은 뚜렷하지 않으나 아래턱 통증을 동반한 두통, 저혈압 및 관류 저하와 동반된 무산소성 실신 발작과 같은 비전형적인 증상을 보였다. 비전형적인 전신 증상을 동반한 급성기 뇌경색 의심 환자에서 정맥내 혈전 용해술의 적응증이 되는 경우, 뇌혈관 전산화단층영상검사를 할 때 대동맥까지 포함한 광범위한 평가를 하여 대동맥질환 유무에 대한 사전 확인이 필요하다.