ņä£ ļĪĀ
ļćīMRI (brain magnetic resonance imaging)Ļ░Ć ļäÉļ”¼ ļ│┤ĻĖēļÉśņ¢┤ ņØæĻĖēņŗżņŚÉņä£ļÅä ļćīMRIļź╝ ņ┤¼ņśüĒĢśļŖö Ļ▓āņØ┤ ĒØöĒĢ£ ņØ╝ņØ┤ ļÉśņŚłļŗż. ļö░ļØ╝ņä£ ļ░£ņ×æņØ┤ ļ░£ņāØĒĢśņŚ¼ ņØæĻĖēņ¦äļŻīļź╝ ļ░øļŖö ĒÖśņ×ÉļōżņŚÉĻ▓īļÅä ļćīMRIļź╝ ļ╣Āļź┤Ļ▓ī Ļ▓Ćņé¼ĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłļŗż. ļćīMRIņØś ļ»╝Ļ░ÉļÅäļÅä ņ”ØĻ░ĆĒĢśņśĆļŗż. ļö░ļØ╝ņä£ ļćīMRIņŚÉņä£ ļćīļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśļŖö ļ»╝Ļ░ÉļÅä ļé«ņĢśļŹś ņŗ£ņĀłņŚÉ ļ╣äĒĢ┤ņä£ ļ░£ņ×æņŚÉ ņØśĒĢ┤ ļćīņŚÉ ļ░£ņāØĒĢśļŖö ļ│æņĀüņØĖ ļ│ĆĒÖöļź╝ ņēĮĻ▓ī Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłļŗż. Ļ░£ņäĀļÉ£ ļćīMRIņØś ĒĢ┤ņāüļÅäļŖö ļ│æļ│ĆņØś ņä▒Ļ▓®ņØä ļŹö ņ×ÉņäĖĒĢśĻ▓ī ĒīīņĢģĒĢĀ ņłś ņ׳Ļ▓ī ĒĢ┤ņŻ╝ņŚłļŗż. ņØ┤ļ¤░ ļ│ĆĒÖöņØś ņśüĒ¢źņ£╝ļĪ£ ļ░£ņ×æņØä ĒĢśļŖö ļÅäņżæņØ┤ļéś ļ░£ņ×æņØä ĒĢ£ ņ¦üĒøäņŚÉ ļćīMRIļź╝ ņ┤¼ņśüĒĢśĻ│Ā ĻĘĖ ņĀäņŚÉļŖö ņēĮĻ▓ī ļ│┤ņ¦Ć ļ¬╗Ē¢łļŹś ļ░£ņ×æņØś ĻĖēņä▒ĻĖ░ņŚÉ ļ░£ņāØĒĢśļŖö ļćīļ│æļ│ĆņØä ņØśņé¼ļōżņØ┤ ņל Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłļŗż. ĻĘĖ Ļ▓░Ļ│╝ļĪ£ ļ░£ņ×æņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö ĻĖēņä▒ļćīļ│æļ│ĆņŚÉ ļīĆĒĢ£ ļćīMRI ņśüņāüņåīĻ▓¼ņØ┤ ļ¦ÄņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ¦ĆņŗØņØ┤ ņČĢņĀüļÉśņŚłļŗż.
ļćīMRIņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ ļćīņŚÉ ļ│æņĀüņ£╝ļĪ£ ņłśļČäĒÖśĻ▓ĮņØ┤ ļ│ĆĒĢśņŚ¼ ļéśĒāĆļéśļŖö ņåīĻ▓¼ņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö ļČĆņ£äņØś ļ▓öņ£äĻ░Ć ļäōĻ▓ī ļČäĒżĒĢ£ļŗż. ļö░ļØ╝ņä£ ņłśļČäĒÖśĻ▓ĮņØś ļ│ĆĒÖöņŚÉ ļ»╝Ļ░ÉĒĢ£ MRIĻĖ░ņłĀņØä ņØ┤ņÜ®ĒĢśļ®┤ ļ│æļ│ĆņØä Ļ┤Ćņ░░ĒĢśĻĖ░Ļ░Ć ņóŗļŗż. ļ░£ņāØĒĢśļŖö ļ│æļ│ĆņØĆ ļīĆĻ░£ ļćīļČĆņóģņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņ¦Ćļ¦ī Ļ╝Ł ĻĘĖļĀćņ¦ĆļŖö ņĢŖļŗż. ļŹöĻĄ¼ļéś ļ░£ņ×æņØ┤ ļćīņäĖĒżņŚÉ ņ¢┤ļ¢ż ļ│ĆĒÖöļź╝ ņØ╝ņ£╝ņ╝£ ļćīMRIņØś ņŗĀĒśĖņŚÉ ļ│ĆĒÖöļź╝ ņØ╝ņ£╝ĒéżļŖöņ¦ĆļŖö ņĢäņ¦ü ņäżļ¬ģĒĢśņ¦Ć ļ¬╗ĒĢśļŖö ļČĆļČäņØ┤ ļ¦Äļŗż.
ļ░£ņ×æņØś ĻĖēņä▒ĻĖ░ņŚÉ ļ░£ņāØĒĢśļŖö ļćīļ│æļ│ĆņØä ļćīMRIņŚÉņä£ Ļ┤Ćņ░░ĒĢśļ®┤ ļŗżļźĖ ņøÉņØĖņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö ļćīļ│æļ│ĆĻ│╝ ļ╣äņŖĘĒĢ£ ņĖĪļ®┤ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ņä£, ļćīņŚ╝, ļćīĻ▓Įņāē, ļćīņóģņ¢æ ļō▒ņØś ļ│æĒä░ļōżĻ│╝ Ēś╝ļÅłļÉśĻĖ░ļÅä ņēĮļŗż. ĻĖēņä▒ĻĖ░ņŚÉ ļ│æļ│ĆņØ┤ Ļ░Éļ│äņØ┤ ļÉśņ¦Ć ņĢŖņĢä ļ░£ņ×æņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ļŖö ļŗżļźĖ ļ│æļ│ĆņØä ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│Ć(brain lesions attributed to acute seizures)ņ£╝ļĪ£ ņśżņØĖĒĢśļ®┤ ĒÖśņ×ÉņŚÉĻ▓ī ĒĢäņÜöĒĢ£ ņ╣śļŻīļź╝ ĒĢśņ¦Ć ņĢŖņĢä ņ×äņāüĻ▓ĮĻ│╝ņŚÉ ņśüĒ¢źņØä ņżä ņłśĻ░Ć ņ׳ļŗż. ĻĘĖņÖĆ ļ░śļīĆļĪ£ ļ░£ņ×æņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢ£ ļ│æļ│ĆņØä ļ░£ņ×æņØä ņ£Āļ░£ĒĢśļŖö ļŗżļźĖ ļ│æļ│Ćņ£╝ļĪ£ ņśżņØĖĒĢśļ®┤ ĒÖśņ×ÉņŚÉĻ▓ī ņ¦Ćļéśņ╣£ ņ╣śļŻīņÖĆ Ļ▓Ćņé¼ļź╝ ĒĢśĻ▓ī ļÉ£ļŗż[1-3]. ņĀĆņ×ÉļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņŚÉ ļīĆĒĢ┤ ņ×äņāüņĀüņ£╝ļĪ£ ļÅäņøĆņØ┤ ļÉśļŖö ņĀĢļ│┤ļź╝ ņĀĢļ”¼ĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ļ│Ė ļĪĀ
1. ļ│æĒā£ņāØļ”¼
1) ļ│æĒā£ņāØļ”¼ņØś Ļ░£ņÜö
ļ░£ņ×æņØś ĻĖēņä▒ĻĖ░ņŚÉ ļ░£ņāØĒĢśļŖö ļćīņØś ļ│æļ│ĆņØĆ ņŗĀĻ▓ĮĒÖ£ņä▒ņØ┤ ņ”ØĻ░ĆĒĢśņŚ¼ ļ░£ņāØĒĢ£ļŗż. ņØ┤ ļ│æļ│ĆņØĆ ļśÉĒĢ£ ņŗĀĻ▓ĮĒÖ£ņä▒ņØ┤ ņ”ØĻ░ĆļÉśņ¢┤ ļéśĒāĆļéśļŖö ļīĆņé¼ ļ░śņØæĻ│╝ ĒśłĻ┤ĆņØś ļ░śņØæĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ļ│æļ│ĆņØä ļ│æĒā£ņāØļ”¼ņĀüņØĖ ļ®┤ņ£╝ļĪ£ ļ│┤ļ®┤ ļČĆņóģņØ╝ Ļ░ĆļŖźņä▒ņØ┤ ļ¦Äņ¦Ćļ¦ī ĒÖĢņĀĢņĀüņ£╝ļĪ£ ĒīÉļŗ©ĒĢśĻĖ░ļŖö ņ¢┤ļĀĄļŗż. ļö░ļØ╝ņä£ ņØ┤ņĀäņØś ļ│┤Ļ│ĀļōżņŚÉņä£ļÅä ņ¦üņĀæņĀüņØĖ ļ│æĒā£ņāØļ”¼ņĀü Ēæ£ĒśäņØä Ēö╝ĒĢśļŖö Ļ▓ā Ļ░Öļŗż. ĒŖ╣Ē׳ ļ░£ņ×æĒÖ£ņä▒ņØ┤ ņ׳ļŖö ņןņåīņŚÉņä£ ļÅÖļ¢©ņ¢┤ņ¦ä Ļ││ņŚÉ ļ░£ņāØĒĢśļŖö ļ│æļ│ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢäņ¦ü ĻĘĖ ļ│æĒā£ņāØļ”¼ĒĢÖņĀüņØĖ ĻĖ░ņĀäņØä ņל ļ¬©ļź┤Ļ│Ā ņ׳ļŗż.
2) ļīĆņé¼ņןņĢĀņÖĆ ņāØĒÖöĒĢÖņĀü ļ│ĆĒÖö
ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ ļ░£ņ×æņŚÉ ņØśĒĢ┤ ļćīņŚÉ ļ░£ņāØĒĢśļŖö ļīĆņé¼ņÖĆ ņŚÉļäłņ¦ĆņÜöĻĄ¼ļ¤ēņØś ļ│ĆĒÖöņÖĆļÅä Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗż. ļ░£ņ×æĒÖ£ņä▒ņØ┤ ņ¦ĆņåŹļÉśļ®┤ ļćīņäĖĒżĻ░Ć ļŗ╣ņØä ļŹöņÜ▒ ļ¦ÄņØ┤ ņé¼ņÜ®ĒĢśĻ▓ī ļÉ£ļŗż. ļ░£ņ×æĒÖ£ņä▒ņØ┤ ņ׳ņØä ļĢī ĒśłļźśĻ░Ć ņ”ØĻ░ĆļÉśņ¦Ćļ¦ī ļćīņäĖĒżĻ░Ć ņé¼ņÜ®ĒĢśļŖö ļŗ╣ņØś ņ¢æņØä ļö░ļØ╝Ļ░Ćņ¦Ć ļ¬╗ĒĢ£ļŗż[2,4,5]. ņŗ£Ļ░äņØ┤ ņ¦ĆļéśĻ│Ā ļŗ╣ņØä ļ¦ÄņØ┤ ņé¼ņÜ®ĒĢśņŚ¼ ņäĖĒżņĢłņŚÉ ņ׳ļŖö ņŚÉļäłņ¦Ć ņĀĆņןĻ│ĀĻ░Ć ļČĆņĪ▒ĒĢśĻ▓ī ļÉśļ®┤ Na+/K+ ATP ĒÄīĒöäĻ░Ć ņĀ£ļīĆļĪ£ ņ×æļÅÖĒĢśņ¦Ć ņĢŖļŖöļŗż. ļ░£ņ×æņØ┤ ļ░£ņāØĒĢśļ®┤ ĻĖĆļŻ©ĒāÉņé░ņŚ╝ņØ┤ ļČäļ╣äļÉśņ¢┤ ĒØźļČäļÅģņä▒ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļŖöļŹ░, ĒÄīĒöäĻ░Ć ņ×æļÅÖĒĢśņ¦Ć ņĢŖņ£╝ļ®┤ ņāüĒÖ®ņØĆ ļŹöņÜ▒ ļéśļ╣Āņ¦äļŗż. ļČäļ╣äļÉ£ ĻĖĆļŻ©ĒāÉņé░ņŚ╝ņØĆ NMDAņłśņÜ®ņ▓┤ņŚÉ ņ×æņÜ®ĒĢśņŚ¼ ņ╣╝ņŖśĻ│╝ ļ¼╝ņØä ņäĖĒżņĢłņ£╝ļĪ£ ĒØśļ¤¼ ļōżņ¢┤Ļ░ĆĻ▓ī ļÉ£ļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ│╝ņĀĢņŚÉ ņØśĒĢ┤ ņäĖĒżņÖĖņĢĪņØ┤ Ļ░ÉņåīĒĢśļ®┤ ļćīMRIņŚÉņä£ ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉśņ¢┤ ņ׳ļŖö Ļ▓āņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ļŗż[5].
ļćīĻ▓ĮņāēņŚÉņä£ļŖö ņ┤łĻĖ░ņŚÉ ņŚÉļäłņ¦ĆņŗżĒī©Ļ░Ć ļ░£ņāØĒĢ£ļŗż. ļ░śļ®┤ņŚÉ ļćīņĀäņ”Øņ¦ĆņåŹņāüĒā£Ļ░Ć ņ¦äĒ¢ēĒĢśļŖö ļÅÖņĢłņŚÉļŖö Ļ│╝ļÅäĒĢ£ ĒÖ£ņä▒ņŚÉ ņØśĒĢ£ ņåÉņāüĻ│╝ ņäĖĒżļÅģņä▒ļČĆņóģņØ┤ ļćīņäĖĒżņŚÉ ļ░£ņāØĒĢśĻ│Ā, ņŗ£Ļ░äņØ┤ ņóĆ ļŹö Ļ▓ĮĻ│╝ĒĢśĻ│Ā ļéśņä£ ļćīņäĖĒżņØś ņŚÉļäłņ¦ĆĻ░Ć Ļ▓░ĒĢŹļÉ£ļŗż. ļö░ļØ╝ņä£ ļćīņäĖĒżņŚÉņä£ ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉśļŖö ļ│æĒā£ņāØļ”¼Ļ░Ć ĻĖēņä▒ļ░£ņ×æļ│æļ│ĆĻ│╝ ĻĖēņä▒ļćīĻ▓Įņāē ņé¼ņØ┤ņŚÉ ļŗżļź┤ļŗż. ļćīņĀäņ”Øņ¦ĆņåŹņāüĒā£Ļ░Ć ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŖö ņāüĒā£ņŚÉņä£ ĻĖēņä▒ļ░£ņ×æļ│æļ│ĆņØ┤ ļ░£ņāØĒĢśļ®┤ ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüĻ│╝ T2Ļ░ĢņĪ░ņśüņāüņŚÉņä£ ņŗĀĒśĖņØś ļ│ĆĒÖöĻ░Ć Ļ▒░ņØś ļÅÖņŗ£ņŚÉ ļ░£ņāØĒĢ£ļŗż. ļ░śļ®┤ņŚÉ ĻĖēņä▒ļćīĻ▓ĮņāēņŚÉņä£ļŖö ļćīņĪ░ņ¦üņŚÉņä£ ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉśļŖö Ļ▓āņØ┤ T2ņŗĀĒśĖņØś ņØ┤ņāüņØ┤ ļéśĒāĆļéśļŖö Ļ▓āļ│┤ļŗż ņĢ×ņä£ļŖö ņØ╝ņØ┤ ņ×ÉņŻ╝ ņ׳ļŗż.
ņ×ÉĻĖ░Ļ│Ąļ¬ģļČäĻ┤æļ▓ĢņØĆ ļ░£ņ×æĻ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ņäĖĒżņØś ļīĆņé¼ņé░ļ¼╝ņØś ļ│ĆĒÖöņÖĆ ņŚÉļäłņ¦ĆņÜöĻĄ¼ļ¤ēņØś ļ│ĆĒÖöļź╝ Ļ░Éņ¦ĆĒĢ£ļŗż. ņ¢æņä▒ņ×Éņ×ÉĻĖ░Ļ│Ąļ¬ģļČäĻ┤æļ▓ĢņØĆ ļ░£ņ×æņ¦üĒøäņŚÉ ļćīņäĖĒżņŚÉ ņĀ¢ņé░ņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż[6,7]. ļćīņĪ░ņ¦üņŚÉņä£ pHĻ░Ć ļ│ĆĒĢśĻ│Ā ņŚÉļäłņ¦ĆņŚÉ ņØśņĪ┤ĒĢśļŖö ļīĆņé¼ņé░ļ¼╝ņØ┤ ļ│ĆĒĢśļ®┤ ņØ┤ ļ│ĆĒÖöļź╝ ņØĖņ×ÉĻĖ░Ļ│Ąļ¬ģļČäĻ┤æļ▓ĢņØä ņé¼ņÜ®ĒĢśļ®┤ Ļ░Éņ¦ĆĒĢĀ ņłś ņ׳ļŗż[7-9]. ņ×ÉĻĖ░Ļ│Ąļ¬ģļČäĻ┤æļ▓ĢņŚÉ ņØśĒĢ┤ Ļ┤Ćņ░░ĒĢ£ N-acetylaspartate (NAA)ļŖö Ļ▓ĮņÜ░ņŚÉ ļö░ļØ╝ Ļ▓░Ļ│╝Ļ░Ć ļŗ¼ļ×Éļŗż. NAAļŖö ļ░£ņ×æņ¦üĒøäņŚÉ Ļ░ÉņåīļÉ£ Ļ▓āņØ┤ ĻĖ░ņłĀļÉśĻĖ░ļÅä ĒĢśņśĆĻ│Ā[10], ņ”ØĻ░ĆļÉ£ Ļ▓āņØ┤ ĻĖ░ņłĀļÉśĻĖ░ļÅä ĒĢśņśĆļŗż[11]. NAAĻ░Ć ņ”ØĻ░ĆļÉ£ Ļ▓āņØĆ ņŗĀĻ▓ĮņäĖĒżĻ░Ć Ļ│╝ļŗżĒĢśĻ▓ī ĒØźļČäĒĢ£ Ļ▓āņØä ņØśļ»ĖĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī, ļ░śļ®┤ņŚÉ NAAļŖö ļ░£ņ×æņ¦üĒøäņŚÉ ņŗĀĻ▓ĮņäĖĒżĻ░Ć ĻĖ░ļŖźņØ┤ ņĀĆĒĢśļÉ£ Ļ▓āņØä ņØśļ»ĖĒĢĀ ņłś ņ׳ļŗż. ļ░£ņ×æņ¦üĒøäņŚÉļŖö ņŗĀĻ▓ĮņäĖĒżĻ░Ć ĒØźļČäĒĢśĻ│Ā ĒØźļČäĒĢ£ ĒøäņŚÉ ĻĖ░ļŖźņØ┤ ņĀĆĒĢśļÉśļŖö ņŚŁļÅÖņĀüņØĖ ļ│ĆĒÖöĻ░Ć ņØ╝ļĀ©ņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ┤Ćņ░░ĒĢśļŖö ņŗ£ĻĖ░ņØś ņĢĮĻ░äņØś ņ░©ņØ┤ņŚÉ ņØśĒĢ┤ņä£ ļ░śļīĆņĀü ņāüĒÖ®ņØ┤ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ņØä Ļ▓ā Ļ░Öļŗż.
3) ļćīļČĆņóģņØś ņ”ØĻ▒░
ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØ┤ ļ░£ņāØĒĢśļŖö ĻĖ░ņĀäņØĆ ņØ┤ļĪĀņĀü ļ¬©ļŹĖĻ│╝ ņŗżĒŚśņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ņä£ ĒīīņĢģĒĢĀ ņłś ņ׳ņŚłļŗż. ļćīMRIņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØä ņäżļ¬ģĒĢśļŖö ļ│æļ”¼ĒĢÖņĀüņØĖ ņ”ØĻ▒░Ļ░Ć ņĀ£ņŗ£ļÉśĻĖ░ļŖö Ē¢łņ¦Ćļ¦ī ņĢäņ¦ü ļ¦Äņ¦ĆļŖö ņĢŖļŗż. ļÅÖļ¼╝ņŚ░ĻĄ¼ņØś ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņŚÉņä£ ņłśņāüļÅīĻĖ░ņÖĆ ļ│äņĢäĻĄÉņäĖĒżņØś ļČĆĻĖ░Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż[12]. ĻĖēņä▒ļ░£ņ×æļ│æļ│ĆņØä ņāØĻ▓ĆĒĢ£ ņ”ØļĪĆņŚÉņä£ļÅä ņŗĀĻ▓ĮņĢäĻĄÉņ”ØĻ│╝ ņäĖĒżļČĆņóģņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā ņŚ╝ņ”ØņØĆ ņŚåņŚłļŗż[13-15]. ļćīMRIļź╝ ņØ┤ņÜ®ĒĢ£ ļÅÖļ¼╝ņŗżĒŚśņØĆ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØ┤ ļćīļČĆņóģņØ┤ļØ╝ļŖö ņ”ØĻ▒░ļź╝ ļ│┤ņŚ¼ ņŻ╝ņŚłļŗż. ļ░£ņ×æņØ┤ ļ░£ņāØĒĢ£ ļćīņØś ĻĄŁņåīļČĆņ£äņŚÉņä£ ņŗĀĻ▓ĮņäĖĒżņØś ņØ┤ņāüņØ┤ ņŗ£ņ×æļÉśļ®┤ ņŗĀĻ▓ĮņäĖĒżļŖö ļČōĻ│Ā ņäĖĒżņÖĖņĢĪņØś ņ¢æņØĆ ļ│ĆļÅÖņØ┤ ņŗ¼ĒĢ┤ņ¦äļŗż. ļö░ļØ╝ņä£ ļćīĻĄ¼ņĪ░ļ¼╝ņØś ņÜ®ņĀüņØ┤ ņØ╝ņŗ£ņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśļŖö ļćīļČĆņóģņØ┤ ļ░£ņāØĒĢ£ļŗż. ņØ┤ļ¤░ ļ│ĆĒÖöļŖö T2Ļ░ĢņĪ░ņśüņāü(T2 weighted image)ņØś ņŗĀĒśĖĻ░ĢļÅäļź╝ ņ”ØĻ░Ćņŗ£Ēé©ļŗż[16,17]. ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņŚÉņä£ļŖö Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłś(apparent diffusion coefficient)ņØś ļ│ĆļÅÖņØ┤ ļ░£ņāØĒĢ£ļŗż[6].
4) ņŗĀĻ▓ĮņåÉņāü
ņĪ░ņ¦üĒĢÖņĀüņØĖ ĒśäņāüņØ┤ Ļ░Ćņן ņל ļ░ØĒśĆņĀĖ ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ĻĖēņä▒ļćīĻ▓ĮņāēņØ┤ļŗż. ĻĖēņä▒ļćīĻ▓ĮņāēņØ┤ ļ░£ņāØĒĢśņśĆņØä ļĢī ļćīņĪ░ņ¦üņŚÉņä£ ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉ£ ņāüĒā£ļŖö ļćīņäĖĒżņŚÉ ņŗĀĻ▓ĮļÅģņä▒ļČĆņóģņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā ņśüĻĄ¼ņĀüņ£╝ļĪ£ ņåÉņāüļÉśņŚłļŗżļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż. ĻĘĖļ¤¼ļéś ļ░£ņ×æņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö ĻĖēņä▒ļ│æļ│ĆņŚÉņä£ļŖö ĻĖēņä▒ļćīĻ▓ĮņāēņØś ļ│æļ│ĆĻ│╝ Ļ░ÖņØĆ ņåīĻ▓¼ņØ┤ ņśüņāüņŚÉņä£ ļ│┤ņŚ¼ļÅä ĒÜīļ│ĄļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. ļö░ļØ╝ņä£ ļ░£ņ×æĻ│╝ ņŚ░Ļ┤ĆļÉ£ ĻĖēņä▒ļ│æļ│ĆņØĆ ņäĖĒżņé¼ņŚÉ ļÅäļŗ¼ĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż[18].
ĻĖēņä▒ļ░£ņ×æļ│æļ│ĆņØä ņāØĻ▓ĆĒĢ£ ņ”ØļĪĆņŚÉņä£ ņŗĀĻ▓ĮņäĖĒżņé¼ļ®ĖņØ┤ ņ׳ļŗżļŖö ņ”ØĻ▒░ļź╝ ņĀ£ņŗ£ĒĢ£ ņ”ØļĪĆļōżļÅä ņ׳ļŗż[19].
5) ļ│æļ│ĆņØś ņ£Āļ░£ņÜöņØĖ
ļćīMRIņŚÉņä£ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØ┤ ļ░£ņ×æņØä Ļ▓ĮĒŚśĒĢśļŖö ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ļ░£ņāØĒĢśļŖö Ļ▓āņØĆ ņĢäļŗłļŗż. ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØ┤ ļ│┤Ļ│ĀļÉ£ ņ”ØļĪĆļōżņØĆ ļīĆĻ░£ ļćīņĀäņ”Øņ¦ĆņåŹņāüĒā£Ļ░Ć ņ׳Ļ▒░ļéś ļ░£ņ×æņØ┤ ļ¼┤ļ”¼ļź╝ ņ¦Ćņ¢┤ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ņØ┤ļŗż. ĻĘĖļ¤¼ļéś ļ░£ņ×æņØ┤ ĒĢ£ ļ▓łļ¦ī ļ░£ņāØĒĢ£ ĒøäņŚÉ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØ┤ ļ░£ņāØĒĢ£ ņ”ØļĪĆļōżņØ┤ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż[12,14,20-23]. ļćīMRIņŚÉņä£ ļ░£Ļ▓¼ļÉśļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ ļćīņĀäņ”Øņ¦ĆņåŹņāüĒā£Ļ░Ć ĻĄŁņåīņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśĻ│Ā ņØ╝ņĀĢĒĢ£ ĻĖ░Ļ░ä ļÅÖņĢłņŚÉļ¦ī ļČäļ¬ģĒĢśĻ▓ī ļéśĒāĆļé£ļŗż. ņØ┤ ļ│æļ│ĆņØĆ ļ¬ć ņØ╝ Ēś╣ņØĆ ļ¬ć ņŻ╝ ļÅÖņĢłļ¦ī ļČäļ¬ģĒĢ£ļŹ░ ņØ┤ļŖö ļ░£ņ×æņ¦ĆņåŹņŗ£Ļ░äĻ│╝ Ļ░ĢļÅäņØś ņ×äĻ│äņ╣śĻ░Ć ņ׳ņ¢┤ņä£ ĻĘĖ ņØ┤ĒĢśļĪ£ ļ░£ņāØĒĢĀ Ļ▓ĮņÜ░ņŚÉļŖö ņØ┤ļ¤░ ļ│ĆĒÖöĻ░Ć ļ░£ņāØĒĢśņ¦Ć ņĢŖņØä Ļ▓āņØ┤ļØ╝ļŖö Ļ▓āņØä ņŗ£ņé¼ĒĢ£ļŗż[4,13]. ļ░£ņ×æņ¦ĆņåŹņŗ£Ļ░äĻ│╝ ļ░£ņ×æĻ░ĢļÅä ņÖĖņŚÉ ļŗżļźĖ ļ│ĆņłśļōżļĪ£ ļ│æļ│ĆņØä ņ£Āļ░£ĒĢśļŖöļŹ░ ņŚŁĒĢĀņØ┤ ņ׳ļŗż. ņØ┤ ļ│ĆņłśņŚÉļŖö ļ░£ņ×æņØś ĒśĢĒā£ņÖĆ ņ£äņ╣ś, ņĢĮļ¼╝ņé¼ņÜ®, ĒÖśņ×ÉņØś ņŚ░ļĀ╣, ļÅÖņŗ£ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņ¦łĒÖś, ņŗ¼ĒśłĻ┤ĆĻ│äĻĖ░ļŖźĻ│╝ ļīĆņé¼Ļ│äĻĖ░ļŖźņØś ļ╣äņČĢņāüĒā£ ļō▒ņØ┤ ĒżĒĢ©ļÉ£ļŗż. ņĀüņØĆ ņłś ņØ┤ĻĖ░ļŖö ĒĢśņ¦Ćļ¦ī ņØ╝ļĀ©ņØś ĒÖśņ×Éļź╝ ļ¼śņé¼ĒĢ£ ļ│┤Ļ│ĀņŚÉņä£, ļćīMRIņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö ņłśļČäņØś ĒÖĢņé░ņĀ£ĒĢ£ņØĆ ņĢłņ¬ĮņĖĪļæÉņŚĮ ļ│æņåīļ│┤ļŗżļŖö ņāłĻ▓ēņ¦łņŚÉ ņóĆ ļŹö ņל ļ░£ņāØĒĢśņśĆļŗż[23].
2. ļ│æļ│ĆņØś ļŗżņ¢æņä▒
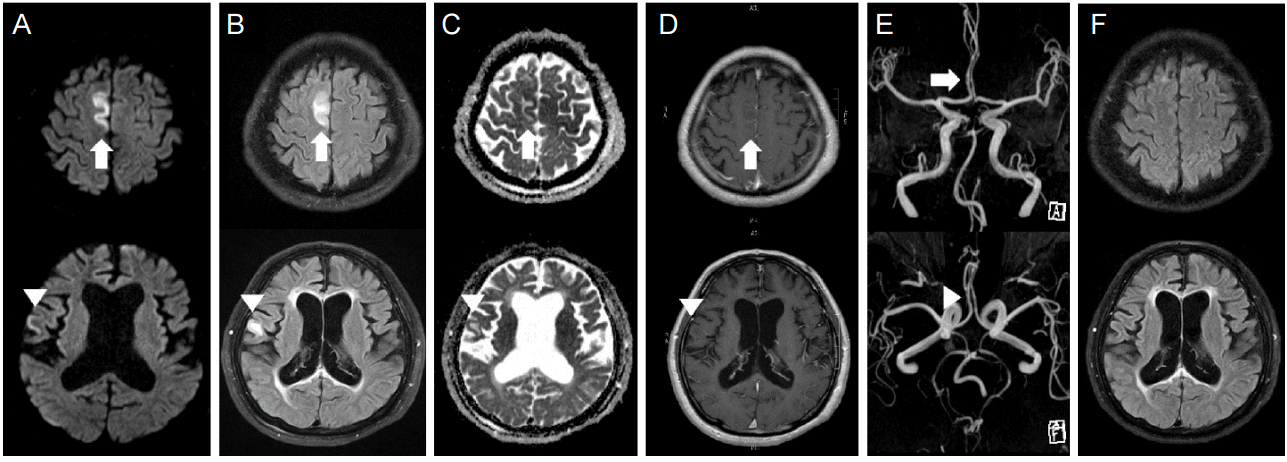
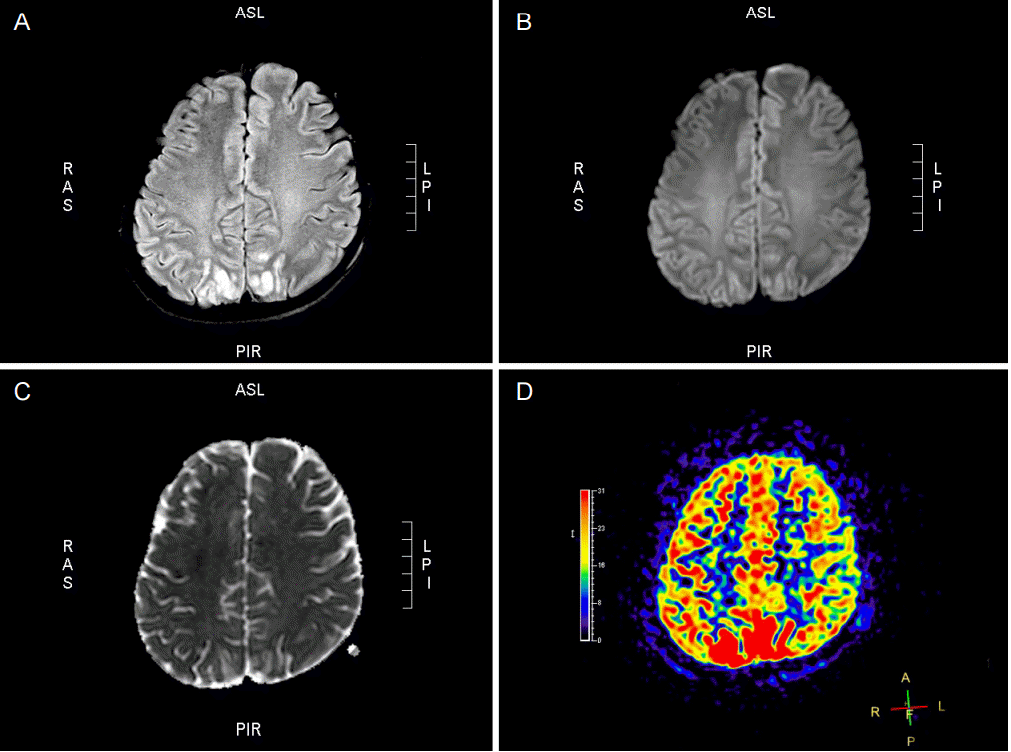
ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ ļ░£ņ×æņżæņŚÉ ļćīņĀäņ”Øļ¬©ņ¢æĒīīĻ░Ć ļ░£ņāØĒĢ£ ļČĆņ£äņŚÉ ņŻ╝ļĪ£ ļ░£ņāØĒĢśļŖöļŹ░, ļćīMRIņŚÉņä£ ļéśĒāĆļéśļŖö ņåīĻ▓¼ņØĆ ļŗżņ¢æĒĢśļŗż[2-5,12-15,20-22,24-31]. ļČĆņóģņØ┤ ļ░£ņāØĒĢ£ļŗżļŖö ņ”ØĻ▒░ļĪ£ ļŹ®ņ¢┤ļ”¼ĒÜ©Ļ│╝ņÖĆ ĻĄ¼Ļ░ÉņćĀ(sulcal effacement)ļéś ņØ┤ļ×æņØīņśüņåīņŗż(effacement of sulci and gyral markings)Ļ│╝ Ļ░ÖņØĆ ņ¢æņāüņØ┤ ļéśĒāĆļéĀ ņłśĻ░Ć ņ׳ļŖöļŹ░ ĒŖ╣Ē׳ ĒĢ┤ļ¦łĻ░Ć ļČōļŖö Ļ▓ĮņÜ░Ļ░Ć ņ×ÉņŻ╝ ņ׳ļŗż. ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØś ĻĄŁņåīĻ▓ēņ¦ł ļČĆņ£äļź╝ ļćīMRIņŚÉņä£ Ļ┤Ćņ░░ĒĢśļ®┤ T2Ļ░ĢņĪ░ņŗĀĒśĖĻ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā ļćīņĪ░ņ¦üņŚÉ ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉ£ļŗż(Table 1, Fig. 1 and 2). ļćīņĪ░ņ¦üņŚÉ ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉśļ®┤ ĒÖĢņé░Ļ░ĢņĪ░ņśüņāü(diffusion weighted imaging)ņŚÉ ļ░ØņØĆ ņŗĀĒśĖĻ░Ć ļéśĒāĆļéśĻ│Ā, Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłśņ¦ĆļÅä(apparent diffusion coefficient maps)ņŚÉņä£ļŖö ņ¢┤ļæÉņÜ┤ ņŗĀĒśĖĻ░Ć ļéśĒāĆļé£ļŗż(Table 1). ļĢīļĪ£ļŖö ļ│æļ│ĆņØ┤ ĻĖēņä▒ĻĖ░ ļÅÖņĢłņŚÉ ņןņåīļź╝ ņØ┤ļÅÖĒĢśĻĖ░ļÅä ĒĢ£ļŗż.
ņ¢Ėļ£╗ ņāØĻ░üĒĢ┤ļ│┤ļ®┤ ļŗżņåī ņØ┤ņāüĒĢśĻĖ░ļÅä ĒĢśņ¦Ćļ¦ī ļ░£ņ×æņØś ĻĖēņä▒ĻĖ░ņŚÉ ļćīņĀäņ”Øļ¬©ņ¢æĒīīĻ░Ć ļ░£ņ×æņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö ĻĖēņä▒ļ│æļ│ĆņØĆ ļćīņĀäņ”Øļ¬©ņ¢æĒīīĻ░Ć ļ░£ņāØĒĢśļŖö ļČĆņ£äņŚÉ ļ░£ņāØĒĢ£ ļČĆņ£äņŚÉņä£ Ļ▒░ļ”¼Ļ░Ć ļ¢©ņ¢┤ņ¦ä ļČĆņ£äņŚÉņä£ ļ░£ņāØĒĢśĻĖ░ļÅä ĒĢ£ļŗż. ļćīņĀäņ”ØĒÖ£ņä▒ņØ┤ ņ׳ņŚłļŹś ļČĆņ£ä ļ¢©ņ¢┤ņ¦ä ņøÉņ£äļČĆņŚÉ ļ░£ņāØĒĢśļŖö ļ│æļ│ĆņØĆ ĻĄÉņ░©ņåīļćīĻĖ░ļŖźĒĢ┤ļ”¼(crossed cerebellar diaschisis), Ļ░ÖņØĆņ¬Įņé¼ņØ┤ļćīĻĖ░ļŖźĒĢ┤ļ”¼(ipsilateral diencephalic diaschisis), ļćīļ¤ēĒīĮļīĆļ│æļ│Ć(lesions on splenium of corpus callosum), Ļ░ĆņŚŁļÆżļćīļ│æņ”ØĒøäĻĄ░(reversible posterior leukoencephalopathy) ļōżņØ┤ļŗż.
3. ļČĆņóģņØś ļćīMRI ņåīĻ▓¼
ļćīļČĆņóģņØä ļ│æļ”¼ĒĢÖņĀüņØĖ Ļ┤ĆņĀÉņŚÉņä£ ļ│┤ļ®┤ ĒśłĻ┤ĆļČĆņóģĻ│╝ ņäĖĒżļÅģļČĆņóģņ£╝ļĪ£ ļéśļłäņ¢┤ ļ│╝ ņłś ņ׳ļŗż. ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│Ćņ£╝ļĪ£ ļ░£ņāØĒĢ£ ļćīļČĆņóģņŚÉļŖö ļ│æļ”¼ĒĢÖņĀüņ£╝ļĪ£ ļŗżļźĖ ņØ┤ ļæÉ Ļ░Ćņ¦Ć ļČĆņóģņØä ļ¬©ļæÉ ĒżĒĢ©ĒĢśĻ│Ā ņ׳ļŗż[28]. ņäĖĒżļÅģļČĆņóģņØĆ ļćīņŗĀĻ▓ĮņäĖĒżĻ░Ć ņ£äņ╣śĒĢśļŖö ļćīĻ▓ēņ¦łņŚÉ ņŻ╝ļĪ£ ļ░£ņāØĒĢśĻ│Ā, ĒśłĻ┤ĆļČĆņóģņØĆ ņŻ╝ļĪ£ Ļ▓ēņ¦łĒĢśļČĆņŚÉ ļ░£ņāØĒĢ£ļŗż(Table 1, Fig. 1). ņØ┤ ļČĆņóģ ņżæņŚÉ ņäĖĒżļÅģļČĆņóģņØĆ ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņŚÉņä£ ņל Ļ┤Ćņ░░ļÉśĻ│Ā ļ│æļ│ĆņØĆ Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļź╝ ļéśĒāĆļéĖļŗż. ņĢĪņ▓┤Ļ░ÉņćĀņŚŁņĀäĒÜīļ│Ąņśüņāü(fluid attenuation inversion recovery image)ņØĆ ĒśłĻ┤ĆļČĆņóģņØä ņל ļ│┤ņŚ¼ņŻ╝ļ»ĆļĪ£ Ļ│ĀņŗĀĒśĖĻ░ĢļÅäĻ░Ć ļćīĻ▓ēņ¦łļ│┤ļŗżļŖö Ļ▓ēņ¦łĒĢśļČĆņŚÉ Ļ░ĢĒĢśĻ▓ī ļéśĒāĆļé£ļŗż. 32 T1Ļ░ĢņĪ░ņśüņāü(T1 weighted image)ņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ļČĆņóģļōżņØ┤ ņĀĆņŗĀĒśĖĻ░ĢļÅäļĪ£ ļéśĒāĆļé£ļŗż[28].
4. ļ│æļ│ĆņØś ņŗ£Ļ░äņĀü Ļ▓ĮĻ│╝
1) ļ░£ņ×æĻ│╝ ļ│æļ│ĆņØś ņŗ£Ļ░äņĀü ņØĖĻ│╝Ļ┤ĆĻ│ä
ļćīņĀäņ”Øļ░£ņ×æņØä ņ£Āļ░£ņŗ£Ēé© ļÅÖļ¼╝ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļ░£ņ×æņŚÉ ņØśĒĢ┤ ļ░£ņāØļÉ£ ļćīļ│æļ│ĆņØ┤ ņŗ£Ļ░äņØ┤ ņ¦Ćļéśļ®┤ņä£ ļ│ĆĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ļ¤░ ļÅÖļ¼╝ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ļŖö ļ░£ņ×æĻ│╝ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØś ņØĖĻ│╝Ļ┤ĆĻ│äļź╝ ļ¬ģĒÖĢĒĢśĻ▓ī ĒĢśļŖö ņ”ØĻ▒░Ļ░Ć ļÉ£ļŗż[33]. ļ░£ņ×æĻ│╝ ņŚ░Ļ┤ĆļÉ£ ĻĖēņä▒ļ│æļ│ĆņØ┤ ņ╣śļŻīĒĢśĻ│Ā ļéśņä£ ņé¼ļØ╝ņĪīļŗżĻ░Ć ļ░£ņ×æņØ┤ ņ×¼ļ░£ĒĢśĻ│Ā ļéśņä£ ļŗżņŗ£ ļ░£ņāØĒ¢łļŹś ņ”ØļĪĆļōżļÅä ļ│┤Ļ│ĀļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņ”ØļĪĆļōżļÅä ļŗżļźĖ ņøÉņØĖņØ┤ ņ׳ļŖö ļ│æļ│ĆņŚÉ ņØśĒĢ┤ ļ░£ņ×æņØ┤ ļ░£ņāØĒĢ£ Ļ▓āņØ┤ ņĢäļŗłļØ╝ ļ░£ņ×æņŚÉ ņØśĒĢ┤ ĻĖēņä▒ļ│æļ│ĆņØ┤ ņāØĻ▓╝ļŗżļŖö ņØĖĻ│╝Ļ┤ĆĻ│äļź╝ ņĀ£ņŗ£ĒĢ┤ ņżĆļŗż[13,27]. ļ»ĖĒåĀņĮśļō£ļ”¼ņĢäļ│æĻ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļŗżņ┤łņĀÉļćīņĀäņ”ØņØ┤ ņ׳ņŚłļŹś ĒĢ£ ļ¬ģņØś ĒÖśņ×ÉņŚÉņä£ ĒŖ╣ņØ┤ĒĢ£ ļćīļ│æļ│ĆļōżņØä Ļ┤Ćņ░░ĒĢ£ ļ│┤Ļ│ĀļÅä ļ░£ņ×æĻ│╝ ļ│æļ│Ć ņé¼ņØ┤ņØś ņØĖĻ│╝Ļ┤ĆĻ│äņŚÉ ļīĆĒĢ£ ņ”ØĻ▒░ļź╝ ņĀ£ņŗ£ĒĢ┤ ņŻ╝ņŚłļŗż[1]. ņØ┤ ĒÖśņ×ÉņØś ļćīņŚÉ ļ░£ņāØĒĢ£ ļ│æļ│ĆņØĆ ņ£äņ╣śĻ░Ć ļ│ĆĒĢśļŖö Ļ▓āņØ┤ ņØ╝ļĀ©ņĀüņ£╝ļĪ£ ņ┤¼ņśüĒĢ£ ļćīMRIņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ĻĘĖ ļ│æļ│ĆļōżņØĆ T2Ļ░ĢņĪ░ņśüņāüĻ│╝ ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņŚÉņä£ ļéśĒāĆļé¼ņ£╝ļ®░, ņØ┤ ļ│æļ│ĆļōżņØĆ ņ¢æņ×Éļ░®ņČ£ļŗ©ņĖĄņ┤¼ņśü(positron emission tomography)ņØś ņåīĻ▓¼Ļ│╝ļÅä ņØ╝ņ╣śĒĢśņśĆļŗż. ņ¢æņ×Éļ░®ņČ£ļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ļŖö ĻĄŁņåīņĀüņ£╝ļĪ£ ļīĆņé¼Ļ░Ć ņĀĆĒĢśļÉ£ ļČĆļČäļōżņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŖöļŹ░ ļćīMRIņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö ļ│æļ│ĆĻ│╝ ņ£äņ╣śĻ░Ć ņØ╝ņ╣śĒĢśņśĆļŹś Ļ▓āņØ┤ļŗż. ļćīĒīīņŚÉņä£ ņØ┤ņāüņåīĻ▓¼ņØ┤ ņĄ£ļīĆņØĖ ļČĆņ£äļÅä ļ│æļ│ĆĻ│╝ ņØ╝ņ╣śĒĢśņśĆļŗż. ņØ┤ ņ”ØļĪĆņŚÉņä£ Ļ┤Ćņ░░ļÉ£ ņØ┤ļÅÖĒĢśļŖö ļ│æļ│ĆļōżļÅä ļ░£ņ×æĒøäņŚÉ ļ░£ņāØĒĢśĻ│Ā ņ£äņ╣śļÅä ĻĖ░ļŖźņĀüņśüņāüņØ┤ļéś ļćīĒīīņØś ņØ┤ņāüņåīĻ▓¼Ļ│╝ļÅä ņØ╝ņ╣śĒĢśņŚ¼, ļćīMRIņŚÉ Ļ┤Ćņ░░ļÉśļŖö ņåīĻ▓¼ņØ┤ ļ░£ņ×æĒÖ£ņä▒ņØś Ļ▓░Ļ│╝ņØ┤ņ¦Ć ņøÉņØĖņØ┤ ņĢäļŗłļØ╝ļŖö Ļ▓āņŚÉ ļīĆĒĢ┤ ņóĆ ļŹö ĒÖĢņŗżĒĢ£ ņ”ØĻ▒░ļź╝ ņĀ£ņŗ£ĒĢ┤ ņŻ╝ņŚłļŗż.
2) Ļ░ĆņŚŁņĀü ĒŖ╣ņä▒
ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ ļīĆļČĆļČä Ļ░ĆņŚŁņĀüņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ņŗ£Ļ░äĻ░äĻ▓®ņØä ļæÉĻ│Ā ļćīMRIļź╝ ļŗżņŗ£ ņ┤¼ņśüĒĢ┤ ļ│┤ļ®┤ ļŗżļźĖ ļ│æļ│ĆļōżĻ│╝ Ļ░Éļ│äĒĢśļŖöļŹ░ Ēü¼Ļ▓ī ļÅäņøĆņØ┤ ļÉ£ļŗż. ĒĢ£ ļ▓ł ļ░£ņāØĒĢ£ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØ┤ ņ£Āņ¦ĆļÉśļŖö ĻĖ░Ļ░äņØĆ Ļ▓ĮņÜ░ņŚÉ ļö░ļØ╝ ļŗżņ¢æĒĢśņ¦Ćļ¦ī ĻĘĖ ļ│æļ│ĆļōżņØĆ ļīĆļČĆļČä ĒÜīļ│ĄļÉśņ¢┤ ņé¼ļØ╝ņ¦äļŗż[28]. ĻĘĖļ¤¼ļéś ņłśĻ░£ņøö ĒøäņŚÉ ņ┤¼ņśüĒĢ£ ļćīMRI ņśüņāüņŚÉņä£ļÅä ņ×öņŚ¼ļ│æļ│ĆņØ┤ ļ¬ģĒÖĢĒĢśĻ▓ī Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ļŗż[4,29]. ņČöņĀüņ£╝ļĪ£ Ļ▓Ćņé¼ĒĢ£ ļćīMRIņŚÉņä£ ĻĄŁņåīņ£äņČĢņØ┤ ļ░£ņāØĒĢśņŚ¼ T2Ļ░ĢņĪ░ņśüņāüĻ│╝ ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņŚÉņä£ ņŗĀĒśĖņØś ļ│ĆĒÖöĻ░Ć ļ░£ņāØĒĢśļŖö Ļ▓āļÅä Ļ░äĒś╣ ļ│┤Ļ│ĀĻ░Ć ļÉ£ļŗż. ĻĘĖļ¤¼ļéś ņØ┤ļ¤¼ĒĢ£ ļ│┤Ļ│Ā ļōżņŚÉņä£ļŖö ĒÖśņ×ÉĻ░Ć ļ░£ņ×æņØ┤ ļ░£ņāØĒĢśĻĖ░ ņĀäņØś ņśüņāüĻ│╝ ļ╣äĻĄÉļÉ£ ņ×ÉļŻīĻ░Ć Ļ▒░ņØś ņŚåņ¢┤ ņÖäļ▓ĮĒĢ£ ņ”ØĻ▒░ļź╝ ņĀ£ņŗ£ĒĢśņ¦ĆļŖö ļ¬╗ĒĢ£ļŗż[2,3,13,14,31].
5. T2Ēł¼ņśüĒÜ©Ļ│╝(T2 shine-through effect)
T2Ēł¼ņśüĒÜ©Ļ│╝ļŖö ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņŚÉņä£ Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļĪ£ ļéśĒāĆļéśĻĖ░ļŖö ĒĢśņ¦Ćļ¦ī ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉśņ¢┤ ļéśĒāĆļéśļŖö Ļ▓ĮņÜ░Ļ░Ć ņĢäļŗī Ļ▓āņØä ļ¦ÉĒĢ£ļŗż. ņØ┤ļŖö T2ņŗĀĒśĖĻ░ĢļÅäĻ░Ć ņ”ØĻ░ĆļÉ£ Ļ▓āņØ┤ ĒÖĢņé░Ļ░ĢņĪ░ņŚÉ Ēł¼ņśüļÉśņ¢┤ ļéśĒāĆļéśļŖö ņåīĻ▓¼ņØ┤ļŗż. Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłśņ¦ĆļÅäļŖö ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö Ļ│ĀņŗĀĒśĖĻ░ĢļÅäĻ░Ć T2Ēł¼ņśüĒÜ©Ļ│╝ņŚÉ ņØśĒĢ£ Ļ▓āņØĖņ¦Ć ĻĖēņä▒ļ│æļ│ĆņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢ£ ņłśļČäĒÖĢņé░ņĀ£ĒĢ£ņŚÉ ņØśĒĢ£ Ļ▓āņØĖņ¦Ćļź╝ Ļ░Éļ│äĒĢśļŖöļŹ░ ļÅäņøĆņØ┤ ļÉ£ļŗż. ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ ņłśļČäņØś ĒÖĢņé░ņØ┤ ņżäņ¢┤ļōżĻĖ░ ļĢīļ¼ĖņŚÉ Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłśņ¦ĆļÅäņŚÉņä£ ņŗĀĒśĖņØś Ļ░ĢļÅäĻ░Ć ļ¢©ņ¢┤ņĀĖ ļéśĒāĆļé£ļŗż. Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłśņ¦ĆļÅäļź╝ ņØ┤ņÜ®ĒĢ┤ļÅä ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņŚÉ ļéśĒāĆļéśļŖö ļ│æļ│ĆņØś ņä▒Ļ▓®ņØä ņĀ£ļīĆļĪ£ ĒīīņĢģĒĢśņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ļŗż. LGI-1ļŗ©ļ░▒, NMDAņłśņÜ®ņ▓┤, GABA-BņłśņÜ®ņ▓┤ļōżĻ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ļ│ĆņŚ░Ļ│ä ļćīņŚ╝ņŚÉ ņØśĒĢ£ ļćīļ│æļ│ĆņØ┤ ĻĘĖ ņśłņØ┤ļŗż. ņØ┤ ĒÖśņ×ÉļōżņŚÉņä£ļŖö ļ░£ņ×æņØ┤ ļ░śļ│ĄļÉśĻ│Ā Ē¢ēļÅÖņØś ļ│ĆĒÖöĻ░Ć ļ░£ņāØĒĢ£ļŗż. ļćīMRIņŚÉņä£ļŖö ļ│ĆņŚ░Ļ│ä ĻĄ¼ņĪ░ļ¼╝ņŚÉ T2ņŗĀĒśĖņØś ļ│ĆĒÖöĻ░Ć ņāØĻĖ░Ļ│Ā ĻĄŁņåīņĀü ņ£äņČĢņØ┤ ļÅÖļ░śļÉśņ¦Ć ņĢŖņ£╝ļ®░ ņĪ░ņśüņ”ØĻ░ĢņØ┤ ļéśĒāĆļé£ļŗż. ĻĘĖļ¤¼ļéś Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłśņ¦ĆļÅäņŚÉņä£ļŖö ņĀĢņāüņØ┤Ļ▒░ļéś T2Ēł¼ņśüĒÜ©Ļ│╝Ļ░Ć ļéśĒāĆļéś ņĀĢņāüņ£╝ļĪ£ ņל ļ¬╗ ĒīÉļŗ©ĒĢĀ ņłśļÅä ņ׳ļŗż[34].
6. ņśüņāüņŚÉ ļéśĒāĆļéśļŖö ĒśłĻ┤ĆĻ│╝ ļćīĻ┤ĆļźśņØś ļ│ĆĒÖö
1) ĒśłĻ┤ĆņØś ļ│ĆĒÖö
ļćīMRĒśłĻ┤ĆņĪ░ņśüņłĀ(brain magnetic resonance angiography)ņØä ņé┤ĒÄ┤ļ│┤ļ®┤ ļ░£ņ×æņØ┤ ļ░£ņāØĒĢ£ ļČĆņ£äņØś ĒśłĻ┤ĆņØ┤ ļÜ£ļĀĘĒĢ┤ņ¦ĆĻ▒░ļéś ņ¦üĻ▓ĮņØ┤ ņ”ØĻ░ĆĒĢśĻĖ░ļÅä ĒĢśļŖöļŹ░ ņØ┤ Ļ▓āļÅä ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØä ĻĖēņä▒ļćīĻ▓ĮņāēņØś ļ│æļ│ĆĻ│╝ Ļ░Éļ│äĒĢśļŖöļŹ░ ļÅäņøĆņØ┤ ļÉśļŖö ņåīĻ▓¼ņØ┤ļŗż(Table 1, Fig. 1). ĒśłĻ┤ĆņØś ņ¦üĻ▓ĮņØ┤ ņ”ØĻ░ĆĒĢśņ¦ĆļŖö ņĢŖņ¦Ćļ¦ī, ļ░£ņ×æņØ┤ ļ░£ņāØĒ¢łļŹś ļīĆļćīļ░śĻĄ¼ņŚÉ Ļ┤æļ▓öņ£äĒĢśĻ▓ī ļ│æļ│ĆņØ┤ ļ░£ņāØĒĢśņśĆļŖöļŹ░ ļ░śĒĢ┤ņä£ ĒśłĻ┤ĆņØś ļ│ĆĒÖöĻ░Ć ņŚåļŖö Ļ▓ĮņÜ░ļÅä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ļŗż(Fig. 2). ļćīņĀäņ”Øņ¦ĆņåŹņāüĒā£ ĒÖśņ×ÉņŚÉņä£ ļćīMRĒśłĻ┤ĆņĪ░ņśüņłĀņØä ĒĢśļ®┤, ļ░£ņ×æņ┤łņĀÉņØ┤ ļÉśņŚłļŹś ļČĆņ£äņŚÉ ĒśłĻ┤ĆļČäņ¦ĆĻ░Ć ļÜ£ļĀĘĒĢśĻ▓ī ļ│┤ņśĆļŗżĻ░Ć ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ĒĢśļ®┤ņä£ ņé¼ļØ╝ņ¦ĆļŖö Ļ▓āņØä ļ│╝ ņłś ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓ĮĻ│╝ļŖö ĒśłļźśņÖĆ Ļ┤ĆĻ│äļÉśņ¢┤ ņĪ░ņśüņØ┤ ņ”ØĻ░ĆļÉśļŖö Ļ▓āņØä ĒåĄĒĢ┤ņä£ļÅä ņĢī ņłś ņ׳ļŗż(Table 1, Fig. 1, Fig. 2)[2,13,29]. ņ┤łĻĖ░ņŚÉ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ ĒśłņĢĪļćīņןļ▓ĮņØ┤ ĒŚłļ¼╝ņ¢┤ņĀĖ ņĪ░ņśüņ”ØĻ░ĢņØ┤ Ļ┤Ćņ░░ļÉśļŖöļŹ░, ņØ┤ ņĪ░ņśüņ”ØĻ░ĢņØĆ ļ│æļ│ĆĻ│╝ ĻĘĖ ņŻ╝ļ│ĆņØś ņŚ░ņłśļ¦ēņŚÉ Ļ┤Ćņ░░ļÉ£ļŗż(Table 1, Fig. 1, Fig. 2). ņØ┤ ņĪ░ņśüņ”ØĻ░Ģ ņåīĻ▓¼ņØĆ ĻĖēņä▒ĻĖ░ņŚÉņä£ļŖö ņĪ░ņśüņ”ØĻ░ĢņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖļŖö ĻĖēņä▒ļćīĻ▓ĮņāēņŚÉ ņØśĒĢ£ ļ│æļ│ĆĻ│╝ ĻĄ¼ļ│äņØ┤ ļÉśļŖö ņåīĻ▓¼ņØ┤ĻĖ░ļÅä ĒĢśļŗż[28].
ļ░£ņ×æņØ┤ ļ░£ņāØĒĢśļŖö ļÅÖņĢłņŚÉ ņĀĢļ¦źĒśłņĢĪņØ┤ ļÅÖļ¦źĒÖöļÉśļŖö Ļ▓āļÅä ļ│┤Ļ│ĀļÉśņŚłļŗż. ņ£Āļ░£ļÉśņŚłĻ▒░ļéś ņ×Éļ░£ņĀüņ£╝ļĪ£ ļ░£ņāØĒĢ£ ļćīņĀäņ”Øļ░£ņ×æņØ┤ ņ׳ļŖö ļÅÖņĢł ļćīĻ▓ēņ¦łņØä ņłśņłĀ ņŗ£ņĢ╝ņŚÉņä£ Ļ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝ņØ┤ļŗż. ļ░£ņ×æņżæņŚÉ ņĀĢļ¦ź ĒśłņĢĪņØ┤ ļÅÖļ¦źĒÖöĒĢśļŖö Ļ▓āļÅä ĻĖēņä▒ļ░£ņ×æļ│æļ│ĆņŚÉņä£ ĒśłĻ┤ĆļČäņ¦ĆĻ░Ć ņŗ£Ļ░äņŚÉ ļö░ļØ╝ ļ│ĆĒÖöĒĢśļŖö ņåīĻ▓¼Ļ│╝ ņØ╝ņ╣śĒĢ£ļŗż[13,35]. ļö░ļØ╝ņä£ ļćīMRĒśłĻ┤ĆņĪ░ņśüņłĀņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņŚÉņä£ ļćīĒśłļźśĻ░Ć ĻĄŁņåīņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØĆ ļÅÖņĀĢļ¦źņģśĒŖĖ(arteriovenous shunting)ļź╝ ņØśļ»ĖĒĢĀ ņłśļÅä ņ׳ļŗż.
2) ļćīĻ┤ĆļźśņØś ļ│ĆĒÖö
ļ░£ņ×æņØ┤ ļ░£ņāØĒĢ£ ļćīņØś ļČĆņ£äņŚÉļŖö ļćīĒśłĻ┤ĆņØ┤ ĒÖĢņןļÉśĻ│Ā ĒśłļźśĻ░Ć ņ”ØĻ░ĆĒĢ£ļŗż. ļ░£ņ×æņżæņŚÉ ļŗ©ņØ╝Ļ┤æņ×Éļ░®ņČ£CT (single-photon emission CT)ļź╝ ņ┤¼ņśüĒĢśļ®┤ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│Ć ļČĆņ£äņŚÉ ļćīĻ┤ĆļźśĻ░Ć ņ”ØĻ░ĆĒĢ£ Ļ▓āņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ļŗż. ĻĖēņä▒ļ░£ņ×æļ░£ņ×æ ĒÖśņ×ÉņŚÉņä£ ļćīMRI ņŗĀĒśĖļź╝ ņŚ░ĻĄ¼ĒĢ£ ļ│┤Ļ│ĀņŚÉņä£ ņŗĀĒśĖĻ░Ć ņ”ØĻ░ĆĒĢ£ ļČĆņ£äņŚÉ ļćīĻ┤ĆļźśĻ░Ć ņ”ØĻ░ĆĒĢ£ Ļ▓āņØä ļŗ©ņØ╝Ļ┤æņ×Éļ░®ņČ£CTļĪ£ ĒÖĢņØĖĒĢśņśĆļŗż[28]. ĻĄŁņåīņĀüņ£╝ļĪ£ ļćīņĀäņ”Øņ¦ĆņåŹņāüĒā£ņŚÉ ņ׳ļŖö ĒÖśņ×ÉņŚÉĻ▓ī gadoliniumņ£╝ļĪ£ ņĪ░ņśüņ”ØĻ░ĢņØä ĒĢ£ ļ»╝Ļ░ÉļÅäĻ░ĢņĪ░ņśüņāü(susceptibility-weighted imaging)ņØä ņ┤¼ņśüĒ¢łņØä ļĢī ļ░£ņ×æļČĆņ£äņŚÉ ļćīĻ┤ĆļźśĻ░Ć ņ”ØĻ░ĆĒĢ£ Ļ▓āļÅä ļ│┤Ļ│ĀļÉśņŚłļŗż. ņØ┤ ĒÖśņ×ÉņŚÉņä£ ļŗ©ņØ╝Ļ┤æņ×Éļ░®ņČ£ CTņŚÉņä£ļÅä Ļ░ÖņØĆ ļČĆņ£äņŚÉ ļćīĻ┤ĆļźśĻ░Ć ņ”ØĻ░ĆļÉśņŚłļŗż[36].
ļ░£ņ×æņØś ĻĖēņä▒ĻĖ░ņŚÉ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņŚÉļŖö Ļ┤ĆļźśĻ░Ć ņ”ØĻ░ĆĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ĻĖēņä▒ĻĖ░ņŚÉ Ļ┤ĆļźśĻ░Ć Ļ░ÉņåīĒĢśļŖö ļćīņĪĖņżæĻ│╝ ļŗżļź┤ļŗż. ĻĘĖļ¤¼ļéś ņØ┤ļĀćĻ▓ī Ļ┤Ćņ░░ļÉśļŖö Ļ┤ĆļźśļÅä ņŗ£Ļ░äņØ┤ ņ¦Ćļéśļ®┤ņä£ ņ¢æņāüņØ┤ ļŗ¼ļØ╝ ņ¦äļŗżļŖö Ļ▓āņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż. ļćīĻ┤ĆļźśMRIņÖĆ ļŗ©ņØ╝Ļ┤æņ×Éļ░®ņČ£CTļŖö ļ░£ņ×æņżæņŚÉ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņŚÉ ņĀäĒśĢņĀüņØ┤Ļ│Ā ĻĄŁņåīņĀüņ£╝ļĪ£ ĒśłļźśĻ░Ć ņ¦Ćļéśņ╣śĻ▓ī ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ļ│┤ņŚ¼ ņŻ╝ņ¦Ćļ¦ī Ļ│╝Ļ┤ĆļźśĻ░Ć ļéśĒāĆļéśļŖö ļČĆņ£äņØś ņŻ╝ņ£äņŚÉļŖö Ļ┤ĆļźśĻ░Ć ņĀĆĒĢśļÉśĻ│Ā ļ░£ņ×æņØ┤ ļüØļéśĻ│Ā ļéśņä£ļŖö Ļ░ÖņØĆ ļČĆņ£äņŚÉ ņāüļīĆņĀüņØĖ ņĀĆĻ┤ĆļźśĻ░Ć ļéśĒāĆļéĀ ņłś ņ׳ļŗż[4,13,37-41]. ņ£äņŚÉņä£ ņåīĻ░£ĒĢ£ ļćīņĀäņ”Øņ¦ĆņåŹņāüĒā£ņŚÉ ņ׳ļŹś ĒÖśņ×ÉņŚÉņä£ Ļ┤Ćņ░░ļÉ£ ļćīĻ┤ĆļźśņØś ņ”ØĻ░ĆļÅä ņŗ£Ļ░äņØ┤ ņ¦Ćļéśņä£ļŖö ņ¢æņāüņØ┤ ļŗ¼ļØ╝ņĪīļŗż. ļ░£ņ×æņØ┤ ļ®łņČś ĒøäņŚÉļŖö ļćīĻ┤ĆļźśMRI, ļŗ©ņØ╝Ļ┤æņ×Éļ░®ņČ£ CT ĻĘĖļ”¼Ļ│Ā ļćīĒīīņŚÉ ļéśĒāĆļé£ ņØ┤ņāü ņåīĻ▓¼ņØ┤ ļ¬©ļæÉ ņĀĢņāüņ£╝ļĪ£ ĒÜīļ│ĄļÉśņŚłļŗż[36]. ļ░£ņ×æņØ┤ ļ░£ņāØĒĢ£ ĒøäņŚÉ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņŚÉ Ļ┤ĆļźśņĀĆĒĢśĻ░Ć ļćīĻ┤ĆļźśMRIņŚÉ ļéśĒāĆļéśļ®┤ ĻĖēņä▒ļćīĻ▓ĮņāēĻ│╝ Ļ░Éļ│äņØ┤ ņ¢┤ļĀżņøī ņ¦äļŗż.
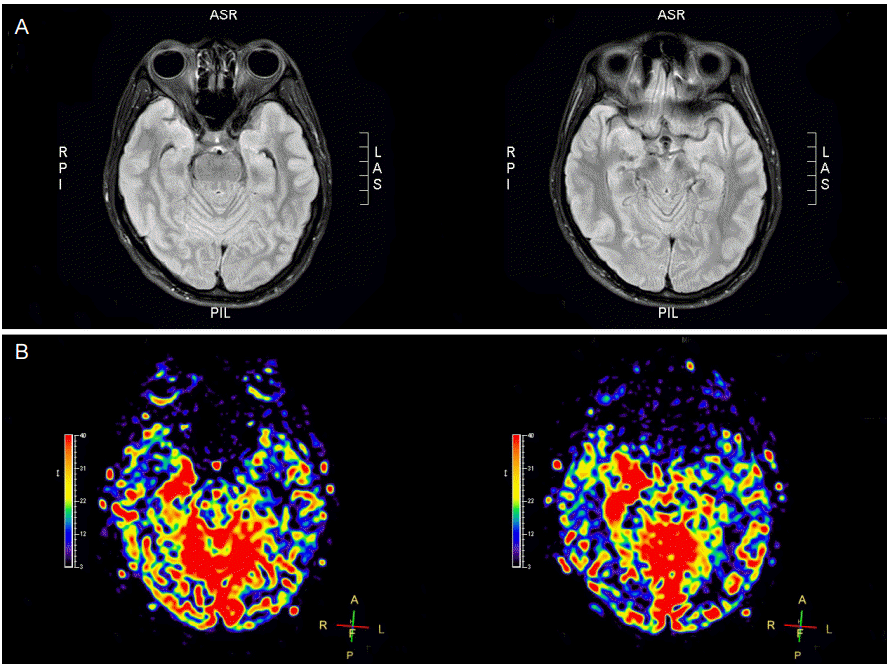
3) ļÅÖļ¦źņŖżĒĢĆĒæ£ņ¦Ć
Ēæ£ņżĆņĀüņØĖ MRI ĻĖ░ņłĀ ņØ┤ņÖĖņŚÉ ļ│æĒā£ņāØļ”¼ņÖĆ ņŚ░Ļ┤ĆļÉ£ ĒśłņŚŁĒĢÖņĀü ļ│ĆĒÖöļź╝ Ļ┤Ćņ░░ĒĢśĻĖ░ ņóŗĻ│Ā Ļ▓Ćņé¼ĒĢśĻĖ░ ņē¼ņÜ┤ ļćīĻ┤ĆļźśMRI ņśüņāüņØ┤ ļŹöĒĢ┤ņĪīļŗż. ļÅÖļ¦źņŖżĒĢĆĒæ£ņ¦ĆĻĖ░ņłĀ(arterial spin labeling)ņØ┤ ļ░öļĪ£ ĻĘĖ ņśüņāüņØ┤ļŗż. ļćīņĀäņ”ØĒÖśņ×ÉļōżņŚÉņä£ ļÅÖļ¦źņŖżĒĢĆĒæ£ņ¦Ćļź╝ ĒżĒĢ©ĒĢ£ ļćīMRIņÖĆ ņ¢æņ×Éļ░®ņČ£ CTļź╝ ļÅÖņŗ£ņŚÉ Ļ▓Ćņé¼ļź╝ ĒĢśļ®┤ ļ░£ņ×æĻ░ä ņĀĆĻ┤Ćļźśļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░ ņØ┤ ņåīĻ▓¼ņØĆ ļćīĒīīņØś ņØ┤ņāüņåīĻ▓¼ņØ┤ļéś ņ¢æņ×Éļ░®ņČ£CTņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö ņĀĆĻ┤ĆļźśņÖĆ ņØ╝ņ╣śĒĢ£ļŗż[42].
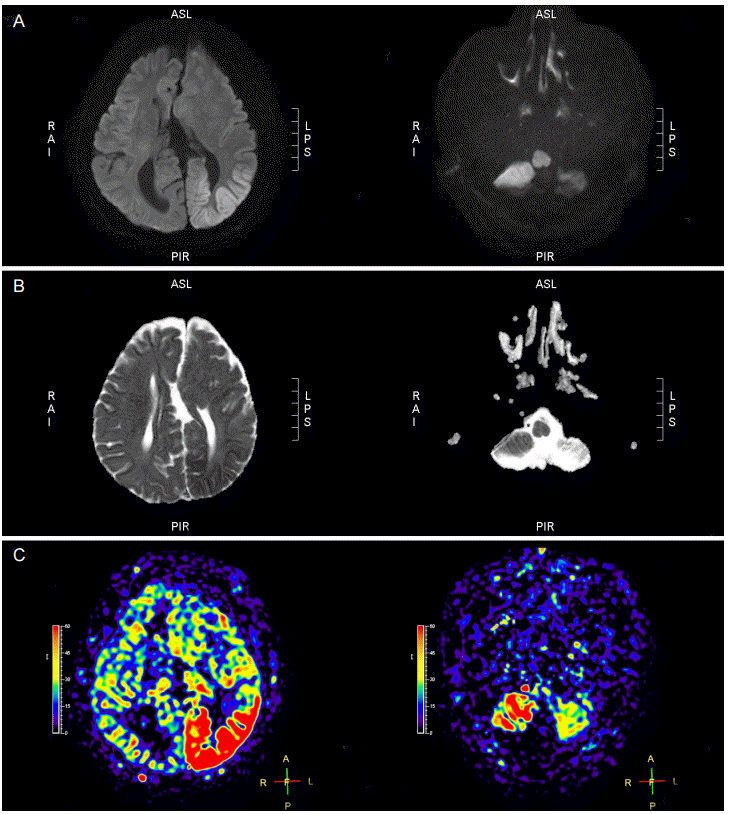
ļÅÖļ¦źņŖżĒĢĆĒæ£ņ¦ĆļŖö ņ×ÉĻĖ░ņĀüņ£╝ļĪ£ Ēæ£ņ¦ĆĻ░Ć ļÉ£ ļÅÖļ¦źĒśłņŚÉ ĒżĒĢ©ļÉśņ¢┤ ņ׳Ļ│Ā ņ×Éņ£ĀļĪŁĻ▓ī ĒÖĢņé░ĒĢśļŖö ņä▒ņ¦łņØ┤ ņ׳ļŖö ļ¼╝ņ¢æņ×Éļź╝ ļé┤ņØĖņČöņĀüĒæ£ņ¦ĆļĪ£ ņØ┤ņÜ®ĒĢśļŖö Ļ▓Ćņé¼ņØ┤ļŗż. ņØ┤ ĻĖ░ļ▓ĢņØä ņé¼ņÜ®ĒĢĀ ļĢīņŚÉ ņÜ░ņäĀņØĆ ļæÉĻ░£ņØś ņśüņāüņØä ļ¦īļōĀļŗż. ņ▓½ ļ▓łņ¦Ė ņśüņāüņØĆ ĒØÉļ”äĒæ£ņ¦ĆņśüņāüņØ┤ļŗż. ļæÉ ļ▓łņ¦Ė ņśüņāüņØĆ ļīĆņĪ░ņśüņāüņØ┤ļŗż. ļīĆņĪ░ņśüņāüņŚÉņä£ ņĢłņĀĢņāüĒā£ ņĪ░ņ¦üņØś ņŗĀĒśĖļŖö ĒØÉļ”ä Ēæ£ņ¦ĆņśüņāüĻ│╝ ļÅÖņØ╝ĒĢśņ¦Ćļ¦ī, ņśüņāüļŗ©ļ®┤ņŚÉ ĒØśļ¤¼ ļōżņ¢┤ņśżļŖö ĒśłņĢĪņØś ņ×ÉĻĖ░ĒÖöļŖö ļŗżļź┤ļŗż[43]. ņØ┤ ĻĖ░ņłĀņŚÉņä£ļŖö Ļ│ĄĻ░äņĀüņ£╝ļĪ£ ņäĀĒāØļÉ£ ņŚŁņĀäņØä ņØ┤ņÜ®ĒĢ£ļŗż[44,45]. ņ┤¼ņśüĒĢśļĀżĻ│Ā ĒĢśļŖö ņĪ░ņ¦üņ£╝ļĪ£ ļÅÖļ¦źĒśłņØ┤ ņ£Āņ×ģļÉśĻĖ░ ņĀäņŚÉ ļ¼┤ņäĀņŻ╝ĒīīņłśĒÄäņŖżļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ļÅÖļ¦źĒśłņŚÉ Ēæ£ņ¦Ćļź╝ ĒĢ£ļŗż. ņĪ░ņ¦üņ£╝ļĪ£ ĒØśļ¤¼ņä£ ļōżņ¢┤Ļ░ĆĻĖ░ ņĀäņŚÉ ļÅÖļ¦źĒśłņØś ļ¼╝ņ¢æņ×ÉņØś ļ░®Ē¢źņØä ļÆżņ¦æĻ▒░ļéś ĒżĒÖöņŗ£ĒéżļŖö Ļ▓āņØ┤ļŗż[46]. ļ¼╝ņ¢æņ×ÉĻ░Ć ņŚŁņĀäļÉ£ ĒśłņĢĪņØś MRIņŗĀĒśĖļŖö ņŚŁņĀäĒśäņāüņØ┤ ņŚåļŖö ļŗżļźĖ ņĪ░ņ¦üņŚÉ ļ╣äĒĢ┤ ņāüļīĆņĀüņ£╝ļĪ£ ņØīņä▒ņØ┤ļŗż. Ēæ£ņ¦ĆĻ░Ć ļÉ£ ĒśłņĢĪņØ┤ ņĪ░ņ¦üņŚÉ ņØ┤ļź┤Ļ▓ī ļÉśļ®┤, ņśüņāüņŚÉņä£ ņĪ░ņ¦üņØś ņŗĀĒśĖļź╝ ņĢĮĒÖöņŗ£Ēé©ļŗż. Ēæ£ņ¦ĆĻ░Ć ļÉ£ ņśüņāüņØä ļīĆņĪ░ņśüņāüņŚÉņä£ ļ╣╝ļ®┤ Ēæ£ņ¦ĆĻ░Ć ļÉ£ ņ¢æņØ┤ ņśüņāüņŚÉ ļéśĒāĆļéśĻ│Ā ņØ┤ Ļ▓āņØĆ ņĪ░ņ¦üņŚÉ ņ£Āņ×ģļÉśļŖö ĒśłļźśņØś ņ¢æņØä ņØśļ»ĖĒĢ£ļŗż(Fig. 3).
ļŗżļźĖ Ļ┤ĆļźśņśüņāüņŚÉ ļ╣äĒĢ┤ņä£, ļÅÖļ¦źĒæ£ņ¦ĆņŖżĒĢĆ ĻĖ░ļ▓ĢņØĆ ļ¬ć Ļ░Ćņ¦Ć ņןņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░, Ēśäņ×¼ņŚÉļŖö ļ¦ÄņØĆ ņØśļŻīĻĖ░Ļ┤ĆņŚÉņä£ ņØ╝ņāüņĀüņ£╝ļĪ£ ĒĢĀ ņłś ņ׳ļŖö Ļ▓Ćņé¼Ļ░Ć ļÉśņŚłļŗż. ļŗ©ņØ╝ņ¢æņĀäņ×ÉCT, ņĪ░ņśüņ”ØĻ░ĢCT ĻĘĖļ”¼Ļ│Ā MRĻ┤ĆļźśņśüņāüņØĆ ņĪ░ņśüņ”ØĻ░ĢņØä ņ£äĒĢ┤ņä£ ļ░®ņé¼ņä▒ņČöņĀüņ×Éļéś ņĪ░ņśüņĀ£ļź╝ ĒÖśņ×ÉņŚÉĻ▓ī Ēł¼ņŚ¼ĒĢ┤ņĢ╝ ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļ░śļ│ĄņĀüļĪ£ Ļ▓Ćņé¼ĒĢśĻĖ░Ļ░Ć ņ¢┤ļĀĄļŗż. ņØ┤ņŚÉ ļ░śĒĢ┤ņä£ ļÅÖļ¦źņŖżĒĢĆĒæ£ņ¦ĆļŖö ĒÖśņ×ÉņŚÉņä£ ņĪ░ņśüņ”ØĻ░ĢņØä ņ£äĒĢ┤ Ēł¼ņŚ¼ĒĢśļŖö Ļ▓āņØ┤ ņŚåļŗżļŖö ņĀÉņŚÉņä£ ļ╣äņ╣©ņŖĄņĀüņØ┤ļŗż[47,48]. ņØ┤ņÖĆ Ļ░ÖņØ┤, ļ╣äņ╣©ņŖĄņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ ņĪ░ņ¦üņØś Ļ┤Ćļźśļź╝ ņĖĪņĀĢĒĢĀ ņłśĻ░Ć ņ׳ņ¢┤ņä£ ļÅÖļ¦źņŖżĒĢĆĒæ£ņ¦ĆļŖö ĒÖśņ×ÉņŚÉņä£ ļ░śļ│ĄņĀüņ£╝ļĪ£ Ļ▓Ćņé¼ļź╝ ĒĢśņŚ¼ Ļ▓ĮĻ│╝ļź╝ Ļ┤Ćņ░░ĒĢśĻ▒░ļéś ļ│æļ│ĆņØś ļ│æĒā£ņāØļ”¼ļź╝ ņŚ░ĻĄ¼ĒĢśļŖö ļŹ░ ņĢłņä▒ļ¦×ņČżņØ┤ļŗż. ņĄ£ĻĘ╝ņŚÉļŖö ĻĖ░ņłĀņĀü ļ░£ņĀäņ£╝ļĪ£ ņØĖĒĢ┤ ļ»╝Ļ░ÉļÅäĻ░Ć ņ”ØĻ░ĆĒĢśņŚ¼ ļŹöņÜ▒ Ļ░ĆļŖźņä▒ņØä ļåÆņśĆļŗż. Ļ░ĆņŚŁļÆżļćīļ│æņ”ØĒøäĻĄ░ņØ┤ ļ░£ņāØĒ¢łņŚłĻ│Ā ļ░£ņ×æņØ┤ ņ¦ĆņåŹļÉśņŚłļÉ£ 2ļ¬ģņØś ĒÖśņ×ÉņŚÉņä£ ļÅÖļ¦źņŖżĒĢĆĒæ£ņ¦Ćļź╝ ļ░śļ│ĄņĀüņ£╝ļĪ£ Ļ▓Ćņé¼ĒĢ£ ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż[49]. ņØ┤ ļæÉļ¬ģņØś ĒÖśņ×ÉņŚÉņä£ ļ░śļ│ĄņĀüņ£╝ļĪ£ ļćīMRIļź╝ ņ┤¼ņśüĒĢśņŚ¼ ļ│æļ│ĆņØś ņŗ£Ļ░äņĀü ļ│ĆĒÖöļź╝ Ļ┤Ćņ░░ĒĢśņśĆļŗż. ļÅÖļ¦źĒæ£ņ¦ĆņŖżĒĢĆĻ│╝ ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņØ┤ ļćīMRIĻ▓Ćņé¼ņŚÉ ĒżĒĢ©ļÉśņŚłĻ│Ā ļ░£ņ×æĻ│╝ ņŚ░Ļ┤ĆĒĢśņŚ¼ ņØ╝Ļ┤Ćņä▒ ņ׳ļŖö Ļ▓░Ļ│╝Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż. ļ░£ņ×æņØ┤ ļ░£ņāØĒ¢łņØä ļĢīņŚÉ ļÅÖļ¦źĒæ£ņ¦ĆĒĢĆņŚÉņä£ļŖö ĻĄŁņåīņĀüņ£╝ļĪ£ Ļ┤ĆļźśĻ░Ć ņ”ØĻ░ĆļÉśņŚłĻ│Ā, ĒÖĢņé░Ļ░ĢņĪ░ņśüņāüņŚÉņä£ļŖö ņØ┤ ļČĆņ£äņŚÉ ļīĆļćīĻ▓ēņ¦łņØś Ļ│ĀņŗĀĒśĖ Ļ░ĢļÅäĻ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż.
7. ļÅÖ ļ¢©ņ¢┤ņ¦ä ļČĆņ£äņŚÉņä£ ļ░£ņāØĒĢśļŖö ļ│æļ│Ć
1) ĻĖ░ļŖźĒĢ┤ļ”¼
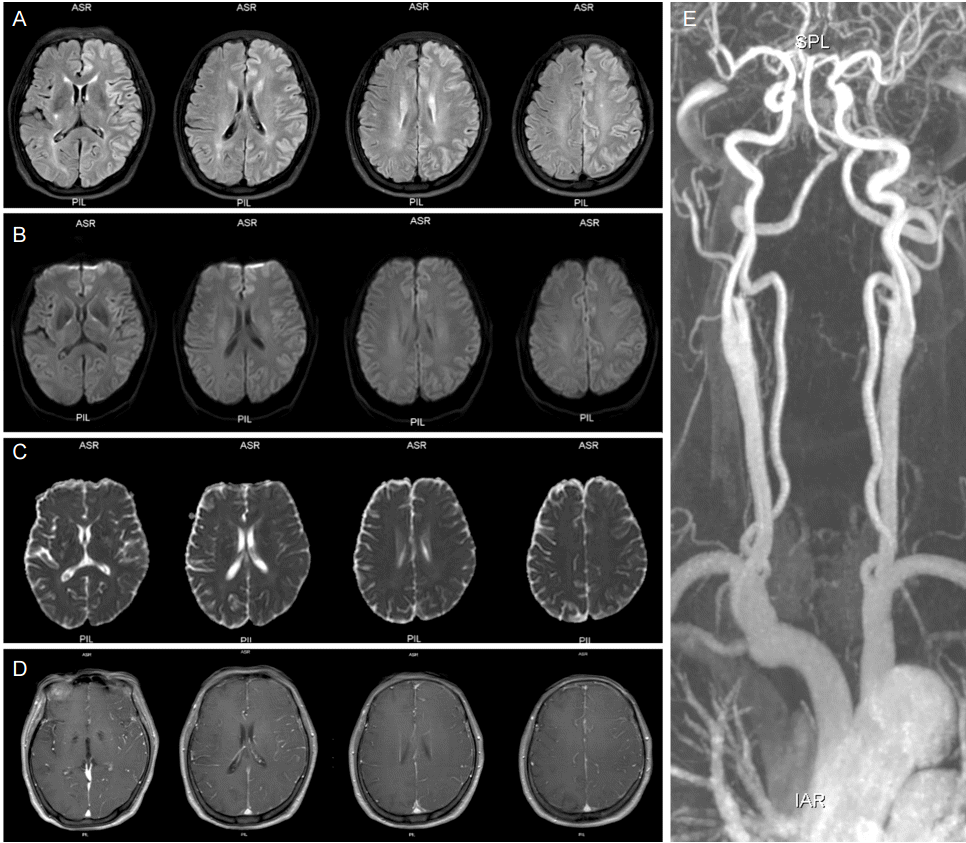
ļ░£ņāØĒĢ£ ļ│æļ│ĆĻ│╝ļŖö Ļ▒░ļ”¼Ļ░Ć ļÅÖļ¢©ņ¢┤ņ¦ä ļćīņØś ĻĄ¼ņŚŁņŚÉ ĻĖ░ļŖźņĀü ņåÉņŗżņØ┤ ļ░£ņāØĒĢśļŖö ĒśäņāüņØ┤ ĻĖ░ļŖźĒĢ┤ļ”¼ņØ┤ļŗż. ĻĖ░ļŖźĒĢ┤ļ”¼Ļ░Ć ļ░£ņāØĒĢ£ ļČĆļČäņØĆ ĒĢ┤ļČĆĒĢÖņĀüņ£╝ļĪ£ļŖö ļÅÖļ¢©ņ¢┤ņĀĖ ņ׳ņ¦Ćļ¦ī ņŗĀĻ▓ĮņäĖĒżņØś ĻĖ░ļŖźņĀü ņĖĪļ®┤ņŚÉņä£ļŖö ņøÉļ░£ļ│æļ│ĆĻ│╝ ņŚ░Ļ▓░ļÉśņ¢┤ ņ׳ļŗż. ĻĄÉņ░©ņåīļćīĻĖ░ļŖźĒĢ┤ļ”¼ļŖö ĒŖ╣Ē׳ ļ░śļīĆņ¬Į ļīĆļćīļ░śĻĄ¼ņØś ņåÉņāüĻ│╝ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗż(Fig. 4). ĻĖ░ļŖźĒĢ┤ļ”¼ņØś ļ│æĒā£ņāØļ”¼ļŖö ņĢäņ¦üĻ╣īņ¦Ć ĒÖĢņŗżĒĢśņ¦ĆļŖö ņĢŖņ¦Ćļ¦ī ņØ┤ļ¤¼ĒĢ£ ĻĖ░ļŖźņĀü ņŚ░Ļ▓░ ļĢīļ¼ĖņŚÉ ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦äļŗż. ļ░£ņ×æĒÖ£ņä▒ņŚÉ ņØśĒĢ┤ ļæÉ ĻĄ¼ņĪ░ ņé¼ņØ┤ņŚÉ ņŗĀĻ▓ĮĒÜīļĪ£ņØś ņŚ░Ļ▓░ņØ┤ ļŖśņ¢┤ļéśĻ│Ā ņØ┤ ļōżņØ┤ ĒØźļČäĒĢśņŚ¼ ļ░£ņāØĒĢśļŖö Ļ▓░Ļ│╝ņØ╝ Ļ▓āņØ┤ļŗż. ĻĖ░ļŖźĒĢ┤ļ”¼ļŖö ļćīņĪĖņżæņŚÉņä£ Ļ░Ćņן ĒØöĒĢśĻ▓ī ĻĖ░ņłĀļÉśņŚłņ£╝ļéś, ļŗżņ¢æĒĢ£ ļćīņØś ļ│æļ”¼ņĀü ņāüĒā£ņŚÉņä£ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ĒÄĖļæÉĒåĄ, ļćīņóģņ¢æ, ļćīņŚ╝ ļō▒ņŚÉņä£ļÅä ĻĖ░ļŖźĒĢ┤ļ”¼Ļ░Ć ļéśĒāĆļéĀ ņłś ņ׳ļŖö Ļ▓āņØ┤ļŗż[50,51]. MRIĻ░Ć ļ│┤ņŚ¼ņŻ╝ļŖö ĻĖ░ļŖźĒĢ┤ļ”¼ņØś ņ”ØĻ▒░ļŖö ņłśļČäĒÖĢņé░ņĀ£ĒĢ£Ļ│╝ T2ņŗĀĒśĖņ”ØĻ░ĆņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ ņåīĻ▓¼ņØĆ ņĀäĒśĢņĀüņ£╝ļĪ£ļŖö ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ĒĢśļ®┤ņä£ ĒÜīļ│ĄļÉ£ļŗż. ĻĘĖļ¤¼ļéś ņÖäņĀäĒĢśĻ▓ī ĒÜīļ│ĄļÉśņ¦Ć ņĢŖĻ│Ā ĻĖ░ļŖźĒĢ┤ļ”¼Ļ░Ć ļéśĒāĆļé£ ļČĆļČäņŚÉ ļ¦īņä▒ ņåÉņāüņØ┤ļéś ņÜ®ņĀüĻ░ÉņåīņÖĆ Ļ░ÖņØĆ ĒØöņĀüņØ┤ ļé©ņØä ņłś ņ׳ļŗż.
ĻĖ░ļŖźĒĢ┤ļ”¼ņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ļćīMRI ņåīĻ▓¼ņØ┤ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│Ćņ£╝ļĪ£ ļéśĒāĆļéśĻĖ░ļÅä ĒĢ£ļŗż. ņłśļČäĒÖĢņé░ņĀ£ĒĢ£Ļ│╝ T2ņŗĀĒśĖņ”ØĻ░ĆĻ░Ć ĻĖēņä▒ļ░£ņ×æĒÖ£ņä▒ņØ┤ ļéśĒāĆļé£ ļ░śĻĄ¼ņÖĆ Ļ░ÖņØĆ ņ¬ĮņØś ņé¼ņØ┤ļćīņÖĆ ļ░śļīĆņ¬ĮņØś ņåīļćīņŚÉ Ļ┤Ćņ░░ļÉśļŖö Ļ▓āņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ ņåīĻ▓¼ņØĆ ļćīņĀäņ”Øņ¦ĆņåŹņāüĒā£ ĒÖśņ×ÉņŚÉņä£ Ļ┤Ćņ░░ļÉ£ Ļ▓āņØ┤Ļ│Ā ļ░£ņ×æņØ┤ ļČĆļČäņĀüņ£╝ļĪ£ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ņÖĆ ņĀäļ░śņĀüņ£╝ļĪ£ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ ļ¬©ļæÉņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż[2,4,13,24,25,29,30,52-54]. ļ░£ņ×æņØ┤ ņĪ░ņĀłļÉśĻ│Ā ļéśņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ļ│æļ│ĆņØĆ ļīĆĻ░£ ņłśņØ╝ņØ┤ļéś ņłśņŻ╝Ļ░Ć ņ¦Ćļéśņä£ ņé¼ļØ╝ņ¦äļŗż. ņØ╝ļ░śņĀüņØĖ ĻĖ░ļŖźĒĢ┤ļ”¼ņØś Ļ▓ĮņÜ░ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ĻĖēņä▒ļ░£ņ×æĻ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļéśĒāĆļé£ ĻĖ░ļŖźĒĢ┤ļ”¼Ļ░Ć ļ░£ņāØĒ¢łļŹś ĒĢ┤ļČĆĒĢÖņĀü ĻĄ¼ņĪ░ļōżņŚÉļÅä ņ£äņČĢņØ┤ ĻĄŁņåīņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśĻĖ░ļÅä ĒĢśņśĆļŗż[25,30,51,53,54].
2) ļćīļ¤ēĒīĮļīĆļ│æļ│Ć
ļćīļ¤ēĒīĮļīĆņŚÉ ļ░£ņāØĒĢśļŖö ņØ╝Ļ│╝ņä▒ ļ│æļ│ĆļÅä ļćīņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ ļ¦ÄņØ┤ ĻĖ░ņłĀļÉśņŚłļŗż[55-63]. ļćīMRIņŚÉņä£ ņØ┤ļ¤¼ĒĢ£ ļ│æļ│ĆņØĆ ļŗ¼Ļ▒ĆĻ│╝ Ļ░ÖņØĆ ļ¬©ņ¢æņØä ĒĢśĻ│Ā ņ׳ņ£╝ļ®░ ņŻ╝ļ│ĆņØś Ļ▓ĮĻ│äĻ░Ć ļÜ£ļĀĘĒĢśņśĆļŗż(Fig. 5). ņØ┤ ļ│æļ│ĆņØĆ T2ņŗĀĒśĖĻ░Ć ņ”ØĻ░ĆĒĢśņśĆĻ│Ā ļćīņĪ░ņ¦üņŚÉ ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉśņŚłĻ│Ā ļ¬ć ņŻ╝Ļ░Ć ņ¦Ćļé£ ĒøäņŚÉ ļćīMRIļź╝ ņ┤¼ņśüĒĢśļ®┤ ņśüņāüņŚÉņä£ ņé¼ļØ╝ņ¦äļŗż[55,59]. ļīĆļČĆļČäņØś Ļ▓ĮņÜ░, ņØ┤ļ¤¼ĒĢ£ ļ│æļ│ĆņØĆ ņ×äņāüņ”ØņāüņØä ņ£Āļ░£ĒĢśņ¦Ć ņĢŖņ¦Ćļ¦ī, ņĀüņØĆ ņłśņØś ĒÖśņ×ÉņŚÉņä£ ņĀĢņŗĀņØ┤ņāüņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ļōżļÅä ļ│┤Ļ│ĀļÉśņŚłļŗż[13]. ļ░▒ņ¦łņØĖ ļćīļ¤ēĒīĮļīĆņŚÉ ļ│æļ│ĆņØ┤ ļéśĒāĆļéśļŖö Ļ▓ā ņÖĖņŚÉļŖö ņØ┤ļ¤¼ĒĢ£ ļ│æļ│ĆļōżņØś ĻĖ░ņĀäņØĆ ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖĻ│Ā ņĀĢĒÖĢĒĢ£ ņä▒Ļ▓®ļÅä ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖļŗż[63].
ļćīļ¤ēĒīĮļīĆņŚÉ ļ░£ņāØĒĢśļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØś ļ¦ÄņØĆ Ļ▓ĮņÜ░Ļ░Ć ņłśņłĀ ņĀäņŚÉ ļ╣äļööņśż-ļćīĒīīĻ░Éņŗ£ņןņ╣śļź╝ ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ ĒĢŁļćīņĀäņ”ØņĢĮņØä ĻĖēĒĢśĻ▓ī ņżäņØ┤ļŖö Ļ│╝ņĀĢņŚÉņä£ ņØ╝ļĀ©ņØś ļ░£ņ×æņØ┤ ļ¼┤ļ”¼ļź╝ ņ¦Ćņ¢┤ ļ░£ņāØĒĢ£ ĒÖśņ×ÉļōżņŚÉņä£ ĻĖ░ņłĀļÉśņŚłļŗż[55-57,59-61]. ņØ┤ļ¤¼ĒĢ£ ļćīļ¤ēĒīĮļīĆņŚÉ ļ░£ņāØĒĢ£ ļ│æļ│ĆņØĆ ĒśłĻ┤ĆļČĆņóģņØ┤ļØ╝Ļ│Ā ņČöņĀĢļÉśņŚłļŗż[57]. ĻĘĖļ¤¼ļéś ļ│æļ│ĆņŚÉņä£ Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłśĻ░Ć Ļ░ÉņåīļÉ£ ņĀÉņØĆ ĒśłĻ┤ĆļČĆņóģņØ┤ļØ╝ļŖö ņØ┤ļĪĀĻ│╝ļŖö ņØ╝ņ╣śĒĢśņ¦Ć ņĢŖĻ│Ā ļīĆņŗĀņŚÉ ĻĘĖ ļ│æļ│ĆņØĆ ļ░£ņ×æĒÖ£ņä▒ ĻĘĖ ņ×Éņ▓┤ņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżļŖö Ļ▓āņØä ņŗ£ņé¼ĒĢ£ļŗż[55]. ļćīļ¤ēĒīĮļīĆņŚÉ ļ░£ņāØĒĢśļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØś ļ│æļ”¼ĒĢÖņĀü ņåīĻ▓¼ņØĆ ņłśņ┤łņØś ĻĘ╣ņåīĻ│ĄĒżĒśĢņä▒(micro-vacuolization)ņØ┤ņŚłļŗż. ņØ┤ ļ│æļ”¼ĒĢÖņĀü ņåīĻ▓¼ņØ┤ T2ņŗĀĒśĖņ”ØĻ░ĆņÖĆ Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłśĻ░Éņåīļź╝ ņäżļ¬ģĒĢśĻ│Ā ļćīļ¤ēĒīĮļīĆ ļ│æļ│ĆņØś Ļ░ĆņŚŁņä▒ņØä ņäżļ¬ģĒĢ┤ņżĆļŗż.
ĒĢ£ ļ│┤Ļ│ĀņŚÉņä£ļŖö ļ░£ņ×æņØ┤ ņŚåļŖö ņāüĒā£ņŚÉņä£ ļćīļ¤ēĒīĮļīĆņŚÉ ļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ ļ│┤Ļ│ĀņØś ļīĆņāüņØ┤ 2ļ¬ģņØś ĒÖśņ×ÉļŖö ĒĢŁļćīņĀäņ”ØņĢĮņØś ļÅģņä▒Ļ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņŚłļŗż. ĻĘĖļ¤¼ļéś ĒĢŁļćīņĀäņ”ØņĢĮĻ│╝ ļ│æļ│ĆņØś ņŚ░Ļ┤Ćņä▒ņØĆ ņ”ØĻ▒░Ļ░Ć ņĢäņ¦ü ļČĆņĪ▒ĒĢśļŗż. ĒĢŁļćīņĀäņ”ØņĢĮņØä ļ│ĄņÜ®ĒĢśļŖö ļ¦ÄņØĆ ĒÖśņ×ÉļōżņØ┤ ļćīMRIļź╝ ņ┤¼ņśüĒĢśņśĆņ¦Ćļ¦ī ĻĘĖļ¤¼ĒĢ£ ļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśļŖö ņØ╝ņØ┤ ļō£ļ¼╝ĻĖ░ ļĢīļ¼ĖņŚÉ ĒĢŁļćīņĀäņ”ØņĢĮ ļÅģņä▒ņØ┤ ņ׳ļŖö ņāüĒā£ņŚÉņä£ ļćīļ¤ēĒīĮļīĆņŚÉ ļ│æļ│ĆņØ┤ ļ░£ņāØĒ¢łļŹś 2ļ¬ģņØś ĒÖśņ×ÉļŖö ņśłņÖĖņĀüņØĖ Ļ▓āņØ╝ ņłś ņ׳ļŗż[58].
3) Ļ░ĆņŚŁļÆżļ░▒ņ¦łļćīļ│æņ”Ø
ļ░▒ņ¦łņØś ļČĆņóģņØ┤ ļīĆļćīņØś ļÆżņ¬ĮņŚÉ Ļ┤æļ▓öņ£äĒĢśĻ▓ī ļ░£ņāØĒĢśĻ│Ā, ĻĘĖ ļ│æļ│ĆņØĆ Ļ░ĆņŚŁņĀüņØ┤Ļ│Ā ņóīņÜ░Ļ░Ć ļīĆņ╣Łņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö Ļ▓āņØ┤ Ļ░ĆņŚŁļÆżļ░▒ņ¦łļćīļ│æņ”ØņØ┤ļŗż(Fig. 6). ņØ┤ ņ”ØĒøäĻĄ░ņŚÉņä£ ļ░£ņ×æņØĆ ņ×äņāüņ¢æņāüņØś ņĀäĒśĢņĀüņØĖ ĒŖ╣ņ¦ĢņØ┤ļŗż. Ļ░ĆņŚŁļÆżļ░▒ņ¦łļćīļ│æņ”ØņØĆ ļīĆĻ░£ Ļ│ĀĒśłņĢĢļćīņŚ╝, ņ×ÉĻ░ä, ņäĖĒżļÅģņä▒ņĢĮ, ļ®┤ņŚŁņ¢ĄņĀ£ņĢĮ ļō▒Ļ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļ░£ņāØĒĢ£ļŗż[64,65]. ĻĘĖļ¤¼ļéś, ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ ņāüĒÖ®ļōżņØ┤ ņŚåņØ┤ ļ░£ņ×æņØä ĒĢ£ ĒÖśņ×ÉņØś ņśüņāüņŚÉņä£ Ļ░ĆņŚŁļÆżļ░▒ņ¦ł ļćīļ│æņ”ØĻ░Ć ļ░£ņāØĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ņ׳ļŗż. ņØ┤ļ¤░ Ļ▓ĮņÜ░ņŚÉļŖö ļ░£ņ×æņ×Éņ▓┤Ļ░Ć ļćīMRI ņåīĻ▓¼ņØä ļ░£ņāØņŗ£Ēé© Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢĀ ņłśļ░¢ņŚÉ ņŚåņ£╝ļéś ņŗżņĀ£ņØś ņ×äņāüņŚÉņä£ļŖö ļ¬©ļōĀ ņāüĒÖ®ņØä ļ░░ņĀ£ĒĢśĻĖ░ļŖö Ēלļōżļŗż. Ļ░æņ×æņŖżļ¤¼ņÜ┤ ĒśłņĢĢņØś ņāüņŖ╣ņØ┤ Ļ░ĆņŚŁļÆżļ░▒ņ¦łļćīļ│æņ”ØņØś ņøÉņØĖņØ┤ ļÉśļŖöļŹ░, ņŗĀņ▓┤ņØś ĒśłņĢĢņØ┤ ĒÖśņ×ÉņØś ĻĖ░ņĀĆĒśłņĢĢņŚÉ ļ╣äĒĢ┤ ņżæļō▒ļÅäļĪ£ ņāüņŖ╣Ē¢łņØä ļĢīņŚÉļŖö ņØ┤ļ¤¼ĒĢ£ ļ│æļ│ĆņØś ņøÉņØĖņ£╝ļĪ£ ņāØĻ░üĒĢśĻĖ░ļŖö ļīĆĻ░£ ņ¢┤ļĀĄļŗż[66]. Ļ░ĆņŚŁļÆżļ░▒ņ¦łļćīļ│æņ”Ø ĒÖśņ×ÉņŚÉņä£ Ļ▓ēļ│┤ĻĖ░ĒÖĢņé░Ļ│äņłśņØś ņłśņ╣śĻ░Ć ļé«ņĢäņ¦Ćņ¦Ć ņĢŖĻ│Ā ņśżĒ׳ļĀż ļåÆņĢäņ¦ĆļŖö Ļ▓ĮņÜ░ļÅä ņ׳ļŗż. ņØ┤ļ¤░ Ļ▓ĮņÜ░ņŚÉļŖö ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆĻ│╝ļŖö ļćīMRI ņåīĻ▓¼ņØ┤ ņāüņČ®ļÉ£ļŗż[65].
8. Ļ░Éļ│äņ¦äļŗ©ņØś ņżæņÜöņä▒
ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ ļŗżļźĖ ļ│æļ│ĆĻ│╝ Ļ░Éļ│äĒĢ┤ ļé╝ ņłś ņŚåļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. ļ░£ņ×æĻ│╝ ņŚ░Ļ┤ĆļÉ£ ĻĖēņä▒ļ│æļ│ĆņØĆ ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ĒĢśļ®┤ņä£ Ļ│äņåŹņĀüņ£╝ļĪ£ ļ│ĆĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņśüņāüĻ▓Ćņé¼ļź╝ ļ░śļ│ĄĒĢśņŚ¼ ĒĢśļ®┤ ļÅäņøĆņØ┤ ļÉśĻ▓Āņ¦Ćļ¦ī, ņ×äņāüņŚÉņä£ļŖö ņ╣śļŻīļ░®Ē¢źņØä Ļ░ĆļŖźĒĢ£ ļ╣Āļź┤Ļ▓ī Ļ▓░ņĀĢĒĢ┤ņĢ╝ ĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. ļ░£ņ×æņØ┤ ļ░£ņāØĒĢ£ ĒÖśņ×ÉņŚÉņä£ ĒŖ╣ņ¦ĢņĀüņØĖ ļćīļ│æļ│ĆņØ┤ ļćīMRIņŚÉņä£ ļ░£Ļ▓¼ļÉśņŚłļŹöļØ╝ļÅä ĒÖśņ×ÉņŚÉĻ▓ī ļ░£ņŚ┤ņØ┤ ņØśņŗØņĀĆĒĢśņÖĆ Ļ░ÖņØĆ ņ”ØņāüļōżņØ┤ ņ׳ņ£╝ļ®┤ ļćīņŚ╝ņŚÉ ņØśĒĢ£ Ļ░ĆļŖźņä▒ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņ╣śļŻīļź╝ ĒĢ┤ņĢ╝ ļćīņŚ╝ ĒÖśņ×ÉĻ░Ć ņĀüņĀłĒĢ£ ņ╣śļŻīļź╝ ļ░øņ¦Ć ļ¬╗ĒĢ┤ ņĢģĒÖöļÉśļŖö Ļ▓āņØä ļ¦ēņØä ņłś ņ׳ļŗż. ņŚäļ░ĆĒ׳ ļ¦ÉĒĢśļ®┤ ņØ┤ļ¤░ ņ¦łĒÖśņØś ĻĖēņä▒ĻĖ░ņŚÉ ĒÖśņ×ÉņØś ļćīMRIņŚÉ ļéśĒāĆļéśļŖö ļ│æļ│ĆņØä ļŗ©ņĀĢĒĢśĻĖ░ļŖö ņ¢┤ļĀĄļŗż. ĒÖśņ×ÉņØś ļćīļ│æļ│ĆņØ┤ ļćīņŚ╝ņŚÉ ņØśĒĢ£ Ļ▓āņØ╝ ņłśļÅä ņ׳Ļ│Ā ļ░£ņ×æņŚÉ ņØśĒĢ£ Ļ▓āņØ╝ ņłśļÅä ņ׳Ļ│Ā ļæÉ Ļ░Ćņ¦Ć ņé¼ĒĢŁņØ┤ ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ļ░£ņāØņŗ£Ēé© ļ│æļ│ĆņØ╝ ņłśļÅä ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņ×äņāüņĀüņØĖ ņé¼ĒĢŁņØä ļ¼┤ņŗ£ĒĢśĻ│Ā ļćīMRIņåīĻ▓¼Ļ│╝ ļ░£ņ×æņŚÉļ¦ī ņ¦æņ░®ņØä ĒĢśļ®┤ ņøÉņØĖņ¦łĒÖśņØä Ļ░äĻ│╝ĒĢśĻ▓ī ļÉ£ļŗż. ņØ┤ņÖĆļŖö ļ░śļīĆļĪ£, ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØä ĻĖēņä▒ĻĖ░ņŚÉ ļ╣äņŖĘĒĢ£ ņ¢æņāüņØä ļ│┤ņØ┤ļŖö ļćīņŚ╝, ļćīņĪĖņżæ, ļćīņóģņ¢æĻ│╝ Ļ░ÖņØĆ ņ¦łĒÖśļōżņŚÉ ņØśĒĢ£ ļ│æļ│Ćņ£╝ļĪ£ ņל ļ¬╗ ĒīÉļŗ©ĒĢśļ®┤ ĒÖśņ×ÉņŚÉĻ▓ī Ļ▓Ćņé¼ļź╝ Ļ│╝ļÅäĒĢśĻ▓ī ĒĢśĻ│Ā ņĀüņĀłĒĢśņ¦Ć ņĢŖņØĆ ņ╣śļŻīļź╝ ĒĢĀ Ļ░ĆļŖźņä▒ļÅä ņ׳ļŗż[2,14,67].
ļćīņŚ╝ ņÖĖņŚÉ ĻĖēņä▒ļćīĻ▓ĮņāēļÅä ļćīMRIņåīĻ▓¼ņØä ņ×äņāüņĀüņ£╝ļĪ£ Ļ╝Ł Ļ░Éļ│äĒĢ┤ņĢ╝ ĒĢśļŖö ņ¦łĒÖśņØ┤ļŗż. ĻĖēņä▒ļćīĻ▓ĮņāēņŚÉ ņØśĒĢ┤ ļćīMRIļ│æļ│ĆņØ┤ ļ░£ņāØĒĢśņśĆļŗżļ®┤ ņ╣śļŻīĻ░Ć ĒÜ©Ļ│╝ņĀüņØ┤Ļ│Ā ņ£äĒŚśņØ┤ ņĀüņØĆ Ļ│©ļōĀĒāĆņ×ä ņĢłņŚÉ ņ╣śļŻīļź╝ ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ ļ╣Āļź┤Ļ▓ī ĒīÉļŗ©ĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż. ļö░ļØ╝ņä£ ĻĖēņä▒ļćīĻ▓ĮņāēļÅä ļćīņŚ╝ņ▓śļ¤╝ Ļ░Éļ│äņØä ļćīMRI ņČöņĀüĻ▓Ćņé¼ņŚÉ ņØśņĪ┤ĒĢĀ ņłśĻ░Ć ņŚåļŗż. ņÜ░ņäĀņØĆ T2ņŗĀĒśĖĻ░Ć ņ”ØĻ░ĆļÉśĻ│Ā ļćīņĪ░ņ¦üņŚÉņä£ ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉ£ ņåīĻ▓¼ņØä Ļ┤Ćņ░░ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ļ╣äņĀĢņāü ņŗĀĒśĖĻ░Ć ļéśĒāĆļéśļŖö ĻĄ¼ņŚŁņØ┤ ĒśłĻ┤ĆņØś ļČäĒż ņśüņŚŁĻ│╝ ņØ╝ņ╣śĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ļŖö ĒśłĻ┤Ćņä▒ ņøÉņØĖņØ┤ļØ╝ĻĖ░ ļ│┤ļŗżļŖö ļ░£ņ×æĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö ļ│æļ│ĆņØ┤ļØ╝ļŖö ļŗ©ņä£Ļ░Ć ļÉĀ ņłś ņ׳ļŗż[2]. ļćīMRĒśłĻ┤ĆņĪ░ņśüņłĀņŚÉņä£ ĒśłĻ┤ĆņØ┤ ļÜ£ļĀĘĒĢ┤ņ¦ĆĻ▒░ļéś ĒśłĻ┤ĆņØś ņ¦üĻ▓ĮņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä Ļ┤Ćņ░░ĒĢśĻ▒░ļéś, T1Ļ░ĢņĪ░ņśüņāüņŚÉņä£ ņĪ░ņśüņ”ØĻ░ĢņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä Ļ┤Ćņ░░ĒĢśļ®┤ ļćīĻ▓ĮņāēņØä ļ░░ņĀ£ĒĢśļŖöļŹ░ ļÅäņøĆņØä ļ░øņØä ņłś ņ׳ļŗż. ļćīĻ┤ĆļźśMRIļéś ļćīĻ┤ĆļźśCTļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļćīĻ┤Ćļźśļź╝ Ļ┤Ćņ░░ĒĢśļŖö Ļ▓āļÅä ļÅäņøĆņØ┤ ļÉ£ļŗż. ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņŚÉņä£ļŖö ļćīĻ┤ĆļźśĻ░Ć ņ”ØĻ░ĆļÉ£ļŗż[4,50,68]. ĻĘĖļ¤¼ļéś ņŗ£ĻĖ░ņŚÉ ļö░ļØ╝ ļćīĻ┤ĆļźśĻ░Ć Ļ░ÉņåīļÉĀ ņłśļÅä ņ׳ļŗż. ļćīĻ┤ĆļźśĻ░Ć Ļ░ÉņåīļÉśņ¢┤ ņ׳ņ¦Ćļ¦ī, MRIļéś CT Ļ┤ĆļźśņśüņāüņŚÉņä£ ĒÅēĻĘĀĒåĄĻ│╝ņŗ£Ļ░ä(mean transit time)ņØ┤ ņ¢æņ¬Į ļīĆļćīļ░śĻĄ¼ ņé¼ņØ┤ņŚÉ ļīĆņ╣ŁņØä ņØ┤ļŻ©Ļ│Ā ņ׳ņ£╝ļ®┤ ļćīĻ▓ĮņāēņØ┤ļØ╝ĻĖ░ ļ│┤ļŗżļŖö ļ░£ņ×æĒøä ņāüĒā£ļź╝ ņØśļ»ĖĒĢ£ļŗż[68,69].
Ļ▓░ ļĪĀ
ļ░£ņ×æņØä ĒĢśļŖö ļÅäņżæņØ┤ļéś ļ░£ņ×æņØ┤ ļüØļé£ ņ¦üĒøäņŚÉ ņ┤¼ņśüĒĢ£ ļćīMRIņŚÉņä£ ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ļŗż. ļ│æļ│ĆņØ┤ ļ░£ņ×æņŚÉ ņØśĒĢ┤ņä£ ļ░£ņāØĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ļćīļ│æļ│ĆņØä ņ┤łļלĒĢĀ ņłś ņ׳ļŖö ļŗżļźĖ ņøÉņØĖņØ┤ ņŚåņ¢┤ņĢ╝ ĒĢśņ¦Ćļ¦ī ļæÉ Ļ░Ćņ¦ĆĻ░Ć ļÅÖņŗ£ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ļŗż. ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│Ćņ£╝ļĪ£ Ļ░Ćņן ĒØöĒĢ£ Ļ▓āņØĆ ĻĄŁņåīļČĆņóģņØ┤ļŗż. ļćīMRIļĪ£ Ļ┤Ćņ░░ĒĢśļ®┤ T2ņŗĀĒśĖĻ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā, ļćīņĪ░ņ¦üņØś ņłśļČäņØś ĒÖĢņé░ņØ┤ ņĀ£ĒĢ£ļÉśļ®░, ņĪ░ņśüņ”ØĻ░ĢņØ┤ Ļ┤Ćņ░░ļÉ£ļŗż. ņČöĻ░ĆņĀüņ£╝ļĪ£ ļćīMRĒśłĻ┤ĆņĪ░ņśüņłĀ, ļćīĻ┤ĆļźśMRIĻ░Ć ĻĄŁņåīļČĆņóģņØä ļŗżļźĖ ļ│æļ│ĆĻ│╝ Ļ░Éļ│äņØä ĒĢśļŖöļŹ░ ļÅäņøĆņØ┤ ļÉ£ļŗż. Ļ▓ĮņÜ░ņŚÉ ļö░ļØ╝ņä£ļŖö ļ░£ņ×æņØ┤ ļ░£ņāØĒĢśļŖö ļČĆņ£äņÖĆ ļÅÖļ¢©ņ¢┤ņ¦ä Ļ││ņŚÉ ļćīļ│æļ│ĆņØ┤ ļ░£ņāØĒĢ£ļŗż. ĻĖēņä▒ļ░£ņ×æĻĖ░ņŚÉ ĒÖśņ×ÉņØś ļćīMRIņŚÉ ļ│æļ│ĆņØ┤ ļéśĒāĆļé¼ņØä ļĢī, ņ×äņāüĻ░ĆļĪ£ ņ¢┤ļĀżņÜ┤ ņĀÉņØĆ ļŗżļźĖ ļ│æļ│ĆĻ│╝ ĻĄ¼ļ│äņØä ĒĢśĻĖ░ ņ¢┤ļĀżņÜ░ļ®░ ĒÖśņ×Éļź╝ ņĀüņĀłĒĢśĻ▓ī ņ╣śļŻīļź╝ ĒĢśĻĖ░ ņ£äĒĢ┤ ļ╣Āļź┤Ļ▓ī ĒīÉļŗ©ĒĢ┤ņĢ╝ ĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄļŗżļŖö Ļ▓āņØ┤ļŗż. ĻĖēņä▒ļ░£ņ×æļćīļ│æļ│ĆņØĆ Ļ░ĆņŚŁņĀüņØĖ Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢäņä£ ļīĆļČĆļČä ņé¼ļØ╝ņ¦Ćņ¦Ćļ¦ī, ļ│æļ│ĆņØ┤ ļé©ļŖö Ļ▓ĮņÜ░ļÅä ņ׳Ļ│Ā ļ│æļ│ĆņØ┤ ņé¼ļØ╝ņ¦ĆļŖö ņŗ£ĻĖ░ļÅä ļŗżņ¢æĒĢśļŗż. ĻĘĖļ¤¼ļéś ņ×äņāüņĀüņ£╝ļĪ£ ĒīÉļŗ©ĒĢ£ ņĀüņĀłĒĢ£ ņŗ£ĻĖ░ņŚÉ ļćīMRIļź╝ ņČöņĀüĒĢśņŚ¼ Ļ▓Ćņé¼ĒĢśļ®┤ ĒÖĢņ¦äĒĢśļŖöļŹ░ ļÅäņøĆņØ┤ ļÉ£ļŗż.